题目内容
有一无色透明的溶液,要确定是否含有以下离子:H+、K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊溶液 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤)。 。
(1)Al3+、Mg2+、NO3-、SO42- 、H+ Fe2+、Ba2+、I-、HCO3-
(2)焰色反应,检验K+;稀HNO3溶液、AgNO3溶液,检验Cl-
解析试题分析:因是无色透明溶液,则不含有Fe2+;根据(1)取少量该溶液,加几滴紫色石蕊试液,溶液显红色,说明溶液显示酸性,氢离子一定存在,所以HCO3-不存在;根据(2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热有无色气体产生,气体(NO)遇空气可以变成红棕色(二氧化氮),说明溶液中含有NO3-,则一定不含有I-;根据(3)取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-;根据(4)取(3)中的上层清夜,加AgNO3,有稳定的白色沉淀生成,且不溶于稀硝酸,则(3)上清液中含有Cl-,由于根据(3)中加入了氯化钡,引入Cl-,不能确定原溶液中是否存在Cl-;根据(5)取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则原溶液中含有Mg2+、Al3+;
(1)综上可知,溶液中一定存在的离子是:Al3+、Mg2+、NO3-、SO42- 、H+,溶液中肯定不存在的离子是:I-、Ba2+、Fe2+、HCO3-,不能确定的有:K+、Cl-。
(2)溶液中的可能存在的阴离子是Cl-,检验方法是为:取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸酸化的硝酸银溶液,若出现白色沉淀则说明含有Cl-;而钾离子的检验需要通过焰色反应。
考点:考查离子共存与离子检验

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能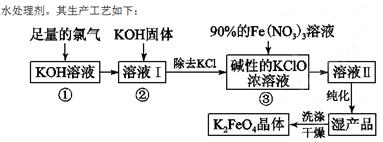
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下: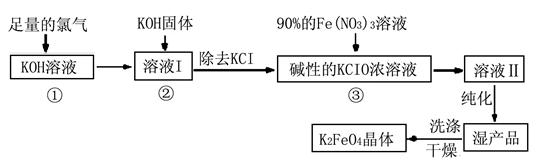
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式 。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式 。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取4份100 mL该溶液分别进行如下实验:
| 实验 序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g |
| D | 加少量KMnO4酸性溶液 | KMnO4溶液褪色 |
试回答下列问题:
(1)根据实验a判断Cl-是否存在________(填“一定存在”、“一定不存在”或“不能确定”)。
(2)该混合物中一定不存在的离子是_______________________________。
(3)①写出实验b中发生反应的离子方程式________。
②写出实验d中使KMnO4酸性溶液褪色的离子方程式________________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
(5)混合物中是否存在K+?________,判断的理由是__________________。
在灾后重建中,饮用水安全占有极为重要的地位,某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42—、HCO3—、NO3—、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液。
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解。
③进行焰色反应实验,只有B、C含有钾离子。
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀。
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象填写下列空白:
(1)写出B、C、D的化学式:B________、C________、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________。
(3)写出实验②发生反应的离子方程式________________________________________
(4)C常用作净水剂,用离子方程式表示其净水原理_______________________________
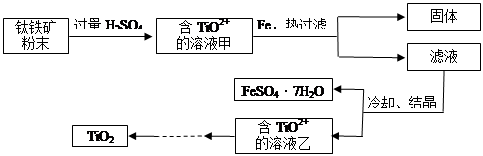
 TiCl4
TiCl4 Ti
Ti