题目内容
16.已知:CO和H2在Co做催化剂、温度为160℃~200℃时,可以合成汽油(即分子中含5至8个碳原子的烷烃).(1)用CnH2n+2表示汽油,写出上述反应的化学方程式nCO+(2n+1)H2$\stackrel{催化剂}{→}$CnH2n+2+nH2O(需配平)
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的$\frac{2}{5}$,通过计算说明是否生成汽油.
(3)以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油.(流程示意图如下,反应③的H2也由反应①得到.)

若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油.
(a)通过计算说明上述方案能否得到理想的产品.
(b)当CO2的使用量应控制为反应①中CO2产量的$\frac{10}{11}$~$\frac{16}{17}$(填比例范围),可以得到理想的产品.
分析 (1)根据题意知用CO和氢气合成汽油的产物除烃外还有水,结合质量守恒定律可写出反应的化学方程式;
(2)据反应方程式分析生成物中的原子组成可知;
(3)(a)根据化学方程式:当n=5~8时,$\frac{8}{17}$>$\frac{n(CO)}{n({H}_{2})}>\frac{5}{11}$分析;
(b)据反应CH4+2H2O$\stackrel{催化剂}{→}$CO2+4H2、CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO、nCO+(2n+1)H2$\stackrel{催化剂}{→}$CnH2n+2+nH2O,分析.
解答 解:(1)根据质量守恒可知反应生成CnH2n+2和水,则反应的方程式为nCO+(2n+1)H2$\stackrel{催化剂}{→}$CnH2n+2+nH2O,
故答案为:nCO+(2n+1)H2$\stackrel{催化剂}{→}$CnH2n+2+nH2O;
(2)当完全反应后,合成塔内温度不变,而塔内气体压强降低到原来的$\frac{2}{5}$,则物质的量为原来的$\frac{2}{5}$,根据反应nCO+(2n+1)H2$\stackrel{催化剂}{→}$CnH2n+2+nH2O,可$\frac{1+n}{n+2n+1}$=$\frac{2}{5}$,得n=3.即恰好反应生成丙烷,无汽油生成,
故答案为:$\frac{1+n}{n+2n+1}$=$\frac{2}{5}$,得n=3.即恰好反应生成丙烷,无汽油生成;
(3)(a)根据化学方程式:
当n=5~8时,$\frac{8}{17}$>$\frac{n(CO)}{n({H}_{2})}>\frac{5}{11}$,而由CH4+2H2O$\stackrel{催化剂}{→}$CO2+4H2、CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO知,若反应①中CO2全部用于合成汽油,则$\frac{n(CO)}{n({H}_{2})}=\frac{1}{2}>\frac{8}{17}$,故不能得到理想产品,故答案为:不能得到理想产品;
(b)当n=5~8时,$\frac{8}{17}$>$\frac{n(CO)}{n({H}_{2})}>\frac{5}{11}$,据反应CH4+2H2O$\stackrel{催化剂}{→}$CO2+4H2、CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO、nCO+(2n+1)H2$\stackrel{催化剂}{→}$CnH2n+2+nH2O,可知,1molCO2能够生成2molCO,所以当CO2的使用量应控制为反应①中CO2产量的$\frac{10}{11}$~$\frac{16}{17}$,可以得到理想的产品,故答案为:$\frac{10}{11}$~$\frac{16}{17}$.
点评 本题考查有机物的合成,题目难度中等,注意从质量守恒的角度书写反应的相关化学方程式,

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 在水溶液中,C6H5COOH的电离方程式为:C6H5COOH?C6H5COO-+H+ | |
| B. | 0.1mol•L-1C6H5COONa溶液中离子浓度大小关系为:c(Na+)>c(C6H5COO-)>c(OH-)>c(H+) | |
| C. | C6H5COONa和C6H5COOH的混合溶液呈中性,且c(Na+)=0.1mol•L-1,则c(Na+)=c(C6H5COO-)>c(OH-)=c(H+) | |
| D. | 等浓度的C6H5COONa和CH3COONa两溶液中,前者离子总浓度小于后者 |
| A. | 12种 | B. | 14种 | C. | 16种 | D. | 18种 |
| A. | 稀硝酸 | B. | 硝酸铜 | C. | 稀盐酸 | D. | 氢氧化钠 |
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
| A. | 目前加碘食盐中主要添加的是KI | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 淀粉、纤维素和聚乙烯都属于天然高分子化合物 | |
| D. | 光纤通信使用的光缆的主要成分和太阳能电池使用的材料都是SiO2 |

 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.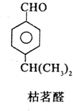 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$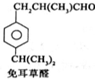
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$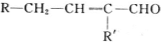
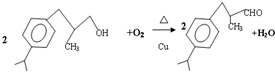 +H20.
+H20. 、
、 .
.