题目内容
6.苯甲酸(C6H5COOH)是一种酸性比醋酸强的弱酸,下列说法不正确的是( )| A. | 在水溶液中,C6H5COOH的电离方程式为:C6H5COOH?C6H5COO-+H+ | |
| B. | 0.1mol•L-1C6H5COONa溶液中离子浓度大小关系为:c(Na+)>c(C6H5COO-)>c(OH-)>c(H+) | |
| C. | C6H5COONa和C6H5COOH的混合溶液呈中性,且c(Na+)=0.1mol•L-1,则c(Na+)=c(C6H5COO-)>c(OH-)=c(H+) | |
| D. | 等浓度的C6H5COONa和CH3COONa两溶液中,前者离子总浓度小于后者 |
分析 A.苯甲酸为弱酸,在溶液中只能部分电离出氢离子,据此判断其电离方程式;
B.C6H5COO-在溶液中部分水解,溶液显示碱性,c(OH-)>c(H+),结合电荷守恒可知c(Na+)>c(C6H5COO-);
C.混合液为中性,则c(OH-)=c(H+),根据电荷守恒可得:c(Na+)=c(C6H5COO-);
D.溶液中正电荷总浓度为c(Na+)+c(H+),阴阳离子总浓度为正电荷的2倍,两溶液中钠离子浓度相等,醋酸钠溶液的水解程度较大,溶液中氢氧根离子浓度较大,则氢离子浓度较小,所以醋酸钠溶液中总电荷浓度小于苯甲酸钠.
解答 解:A.苯甲酸为弱酸,在溶液中部分电离,则C6H5COOH在水溶液中的电离方程式为:C6H5COOH?C6H5COO-+H+,故A正确;
B.0.1mol•L-1C6H5COONa溶液中,C6H5COO-在溶液中部分水解,溶液显示碱性,c(OH-)>c(H+),结合电荷守恒可知c(Na+)>c(C6H5COO-),则溶液中离子浓度大小关系为:c(Na+)>c(C6H5COO-)>c(OH-)>c(H+),故B正确;
C.C6H5COONa和C6H5COOH的混合溶液呈中性,则(OH-)=c(H+),根据电荷守恒可得:c(Na+)=c(C6H5COO-),溶液中离子浓度关系为:c(Na+)=c(C6H5COO-)>c(OH-)=c(H+),故C正确;
D.苯甲酸的酸性大于乙酸,则等浓度的苯甲酸钠的水解程度小于乙酸钠,苯甲酸钠溶液中的氢氧根离子浓度小于乙酸钠溶液,苯甲酸钠溶液中的氢离子答于乙酸钠,根据电荷守恒可知,溶液中离子总浓度为2[c(Na+)+c(H+)],所以苯甲酸钠溶液中的总电荷浓度大于乙酸钠,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握判断离子浓度大小常用的方法,D为易错点,可以根据电荷守恒及盐的水解原理进行判断.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | 动物油加入稀硫酸生产肥皂 | |
| B. | 天然气、液化石油气的成分相同 | |
| C. | 乙烯和乙醛都能发生加成反应 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |
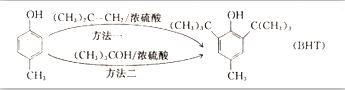
| A. | 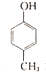 有五种同分异构体 有五种同分异构体 | B. | 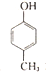 与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT具有还原性不能发生还原反应 | D. | 两种方法的反应类型都是加成反应 |
| A. | 用含有铁粉的透气小袋与食品一起密封包装,说明铁粉能吸收水分 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,利用了硫酸铝溶液与碳酸氢钠溶液混合后能发生剧烈双水解反应 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
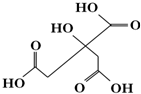
| A. | X分子式为C6H6O7 | |
| B. | 1 mol物质X可以和3 mol氢气发生加成 | |
| C. | X分子不可以发生消去反应 | |
| D. | 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
| A. | 硅是一种灰黑色的金属单质,是现代信息产业的重要元素 | |
| B. | 海水淡化能解决淡水供应危机,淡化海水的方法有蒸馏法、离子交换法、电渗析法等 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 |
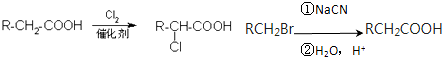
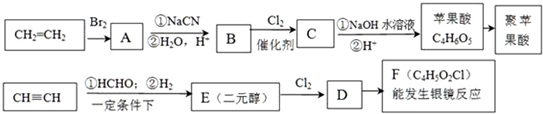
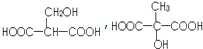 .
.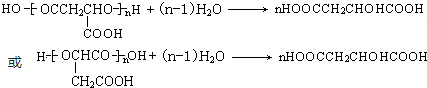 .
.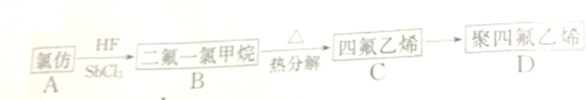
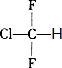 .
. ;,反应类型是加聚反应.
;,反应类型是加聚反应.