题目内容
【题目】下列指定反应的离子方程式正确的是
A.Cl2通入水中制氯水:![]()
B.NO2通入水中制硝酸:![]()
C.![]() NaAlO2溶液中通入过量CO2:
NaAlO2溶液中通入过量CO2:![]()
D.![]() AgNO3溶液中加入过量浓氨水:
AgNO3溶液中加入过量浓氨水:![]()
【答案】C
【解析】
A.次氯酸为弱酸,书写离子方程式时应以分子形式体现,正确的是Cl2+H2O![]() H++Cl-+HClO,故A错误;
H++Cl-+HClO,故A错误;
B.NO2与H2O反应:3NO2+H2O=2HNO3+NO,离子方程式为3NO2+H2O=2H++2![]() +NO,故B错误;
+NO,故B错误;
C.碳酸的酸性强于偏铝酸,因此NaAlO2溶液通入过量的CO2,发生的离子方程式为![]() +CO2+2H2O=Al(OH)3↓+
+CO2+2H2O=Al(OH)3↓+![]() ,故C正确;
,故C正确;
D.AgOH能与过量的NH3·H2O反应生成[Ag(NH3)2]OH,故D错误;
答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】参考下列图表和有关要求回答问题:
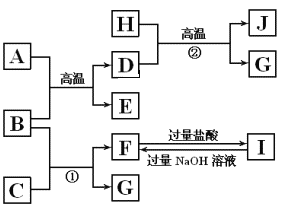
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。