题目内容
【题目】下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
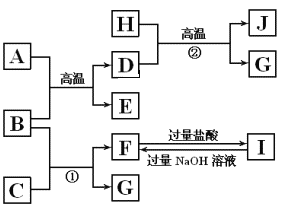
根据图示回答问题:
(1)写出下列物质的化学式:A ______,E______;
(2)反应①的化学方程式是_________________________ ;
反应②的化学方程式是___________________________ ;
(3)J与盐酸反应的化学方程式是______________________ ;
反应后的溶液与足量的D反应的离子方程式是______________________,如何检验最后溶液中的阳离子:______________________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。
【答案】Fe2O3 Al2O3 2Al+NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+4H2O![]() Fe3O4+3H2 Fe3O4+8HCl=FeCl2+FeCl3+4H2O 2Fe3++Fe=3Fe2+ 取少量溶液与试管中滴加硫氰化钾溶液,不变色,再通入氯气变血红色,证明含有二价铁离子 2Fe3+ +3ClO-+10OH- =2FeO42-+3Cl-+5H2O((或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O)
Fe3O4+3H2 Fe3O4+8HCl=FeCl2+FeCl3+4H2O 2Fe3++Fe=3Fe2+ 取少量溶液与试管中滴加硫氰化钾溶液,不变色,再通入氯气变血红色,证明含有二价铁离子 2Fe3+ +3ClO-+10OH- =2FeO42-+3Cl-+5H2O((或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O)
【解析】
此题为框图型推断题,解题的突破口有: B地壳中含量最高的金属,为Al;J为磁性材料,故为Fe3O4,②反应条件为高温,该反应为铁和水蒸气的反应G为氢气;B(Al)和C反应生成G(H2)和F,I加入过量NaOH得到F,故C为NaOH,F为NaAlO2,结合A和B的反应条件为高温,可知为铝热反应,D为Fe,E为Al2O3,据此解答。
(1)根据以上分析,A和B在高温下的反应为Al与Fe2O3在高温下发生的铝热反应,生成和Al2O3和Fe,故A的化学式为:Fe2O3,E的化学式为:Al2O3;
故答案为:Fe2O3;Al2O3;
(2) 根据以上分析,B为Al,C为氢氧化钠溶液,反应①是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式是2Al+NaOH+2H2O=2NaAlO2+3H2↑;
反应②是铁在高温下和水蒸汽反应生成四氧化三铁和氢气,化学方程式是3Fe+4H2O![]() Fe3O4+3H2;
Fe3O4+3H2;
故答案为:2Al+NaOH+2H2O=2NaAlO2+3H2↑;3Fe+4H2O![]() Fe3O4+3H2;
Fe3O4+3H2;
(3)J为Fe3O4,Fe3O4与盐酸反应生成氯化铁、氯化亚铁和水,化学方程式是Fe3O4+8HCl=FeCl2+FeCl3+4H2O;反应后的溶液含有Fe3+与足量的Fe反应的离子方程式是2Fe3++Fe=3Fe2+,最后溶液中的阳离子主要是Fe2+,检验的方法是取少量溶液与试管中滴加硫氰化钾溶液,不变色,再通入氯气变血红色,证明含有二价铁离子。
故答案为:Fe3O4+8HCl=FeCl2+FeCl3+4H2O;2Fe3++Fe=3Fe2+;取少量溶液与试管中滴加硫氰化钾溶液,不变色,再通入氯气变血红色,证明含有二价铁离子;
(4)次氯酸钾中氯+1价具有强氧化性,可将+3价的铁氧化成+6价,用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为:2Fe3+ +3ClO-+10OH- =2FeO42-+3Cl-+5H2O(或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O),
故答案为:2Fe3+ +3ClO-+10OH- =2FeO42-+3Cl-+5H2O(或2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O)。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案