题目内容
【题目】氮和硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)![]() 2NO2(g)的基元反应如下(E为活化能):
2NO2(g)的基元反应如下(E为活化能):
2NO(g)![]() N2O2(g) E1=82kJ·mol-1 v=k1c2(NO)
N2O2(g) E1=82kJ·mol-1 v=k1c2(NO)
N2O2(g)![]() 2NO(g) E-1=205kJ·mol-1 v=k-1c(N2O2)
2NO(g) E-1=205kJ·mol-1 v=k-1c(N2O2)
N2O2(g)+O2(g)![]() 2NO2(g) E2=82kJ·mol-1 v=k2 c(N2O2)·c(O2)
2NO2(g) E2=82kJ·mol-1 v=k2 c(N2O2)·c(O2)
2NO2(g)![]() N2O2(g) + O2(g) E-2=72kJ·mol-1 v=k-2 c2(NO2)
N2O2(g) + O2(g) E-2=72kJ·mol-1 v=k-2 c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g) H=__kJ·mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=__;
2NO2(g) H=__kJ·mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=__;
②某温度下反应2NO(g) +O2(g)![]() 2NO2(g)的速率常数k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率是__mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的__倍。
2NO2(g)的速率常数k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率是__mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的__倍。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2→2VO2+SO3(快) 4VO2+O2→2V2O5(慢)
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2→2VO2+SO3(快) 4VO2+O2→2V2O5(慢)
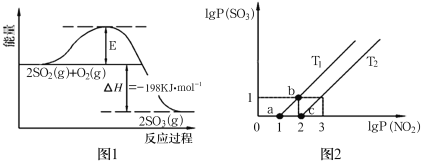
下列说法正确的是__(填序号)。
a.反应速率主要取决于V2O5的质量
b.VO2是该反应的催化剂
c.逆反应的活化能大于198kJ·mol-1
d.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)![]() NO(g)+SO3(g) H<0中1gP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g) H<0中1gP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①T1__T2(填“>”“<”或者“=”),温度为T1时化学平衡常数Kp=__。
②由平衡状态a到b,改变的条件是__。
【答案】-113 ![]() 1.1×10-5 8 CD < 1×10-2 保持温度为T1,将容器体积缩小为原来的
1.1×10-5 8 CD < 1×10-2 保持温度为T1,将容器体积缩小为原来的![]()
【解析】
(1)①根据基元反应含义,第1、3反应为正方向的2个基元反应,第2、4为逆方向的2个基元反应,△H=E2+E1-E-1-E-2,平衡常数 ,据此计算;
,据此计算;
②当反应物浓度都是0.05mol·L-1时,反应的速率为:kc2(NO)·c(O2)=8.8×102L2·mol2·s1×(0.05mol)3=1.1×105mol·L-1·s-1;缩小体积,压强增大;
(2)A.反应速率取决于慢反应速率;
B.VO2是该反应的中间态;
C.生成物总能量低,逆反应的活化能大于198kJ/mol;
D.根据有效碰撞理论,增大SO2的浓度可显著提高反应速率;
(3)①该反应的正反应为放热反应,温度越高,Kp越小;温度为T1时化学平衡常数 ,据此计算;
,据此计算;
②根据坐标可知,由平衡状态a到b,改变的条件是将容器体积缩小为原来的![]() ;
;
(1)①根据基元反应含义,第1、3反应为正方向的2个基元反应,第2、4为逆方向的2个基元反应,2NO(g)+O2(g)![]() 2NO2(g) △H=E2+E1-E-1-E-2=-113kJ·mol-1,平衡常数
2NO2(g) △H=E2+E1-E-1-E-2=-113kJ·mol-1,平衡常数 ,反应到达平衡时,v正=v逆,所以k1c2(NO)= k-1c(N2O2),k2c(N2O2)·c(O2)= k-2c2(NO2),则有
,反应到达平衡时,v正=v逆,所以k1c2(NO)= k-1c(N2O2),k2c(N2O2)·c(O2)= k-2c2(NO2),则有 ,故答案为:-113;
,故答案为:-113;![]() ;
;
②某温度下反应2NO(g)+O2(g)![]() 2NO2(g)的速率常数:k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率为:
2NO2(g)的速率常数:k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率为:
kc2(NO)·c(O2)=8.8×102L2·mol2·s1×(0.05mol)3=1.1×105mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,浓度增大为原来的2倍,则反应速率增大为之前的23=8倍,故答案为:1.1×10-5;8;
(2)A.V2O5的质量不影响反应速率,反应速率取决于慢反应速率,A错误;
B.VO2是该反应的中间态,并非催化剂,催化剂为V2O5,B错误;
C.生成物总能量低,逆反应的活化能大于198kJ/mol,C正确;
D.根据有效碰撞理论,增大SO2的浓度可显著提高反应速率,D正确;故答案为:CD;
(3)①该反应的正反应为放热反应,温度越高,Kp越小,则T1<T2;温度为T1时化学平衡常数 ,故答案为:<;1×10-2;
,故答案为:<;1×10-2;
②根据坐标可知,由平衡状态a到b,改变的条件是保持温度为T1,将容器体积缩小为原来的![]() ,故答案为:保持温度为T1,将容器体积缩小为原来的
,故答案为:保持温度为T1,将容器体积缩小为原来的![]() 。
。

【题目】实验室用NaOH固体配制250 mL 1.25 mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250 mL 1.25 mol/L的NaOH溶液
应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
__________ | __________ | __________ |
(2)容量瓶上需标有以下五项中的__________;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)__________;
A、用30 mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是__________,溶液注入容量瓶前需恢复到室温,这是因为__________
(5)下列配制的溶液浓度偏低的是(_____)
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
E.配制前,容量瓶中有少量蒸馏水
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
B | 室温下,向 | 镁与盐酸反应放热 |
C | 室温下,向浓度均为 | 白色沉淀是BaCO3 |
D | 向 | H2O2具有氧化性 |
A.AB.BC.CD.D