题目内容
已知胆矾在不同温度下可以逐步失去结晶水:CuSO4·5H2O![]() CuSO4·3H2O
CuSO4·3H2O![]() CuSO4·H2O
CuSO4·H2O![]() CuSO4
CuSO4
某课外活动小组准备用浓硫酸和铜片为主要原料制取少量胆矾,其主要步骤有:①取少量铜片放在干燥的蒸发皿内,用酒精灯灼烧到其表面变黑为止;②向蒸发皿内加入一定量浓硫酸并加热,反应结束后发现有少量黑色固体及白色固体存在;③将上述冷却后的反应混合物用水稀释得蓝色溶液,白色固体消失,但仍有黑色固体存在;④向稀释后的所得溶液中加入过量碱式碳酸铜[Cu2(OH)2CO3],充分搅拌;⑤过滤,弃去不溶物;⑥将滤液转回洗净的蒸发皿内,用沸水浴缓缓加热蒸发,浓缩至表面有晶膜析出时为止,取下蒸发皿使溶液冷却,析出蓝色晶体。
(1)步骤⑤中要用到的玻璃仪器有_________________________________________________。
(2)步骤④中发生反应的离子方程式是____________________________________________。
(3)简述步骤③的具体操作方法:________________________________________________。
(4)下列叙述错误的是_____________
A.将铜片灼烧,可以减少浓硫酸的消耗量
B.用浓硫酸溶解灼烧后的铜片时,应在通风橱中进行
C.步骤②中得到的黑色固体是CuO
D.步骤②中得到的白色固体是CuSO4
E.步骤⑥中为加快蒸发速度,也可用酒精灯直接给蒸发皿加热
(1)漏斗、烧杯、玻璃棒
(2)Cu2(OH)2CO3+4H+====2Cu2++CO2↑+3H2O
(3)将反应混合物沿烧杯内壁倒入盛有适量水的烧杯中,并用玻璃棒不断搅拌
(4)C、E
解析:本题主要考查了仪器的使用,化学实验基本操作、实验操作过程中注意的问题等知识点。

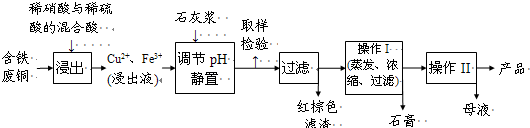
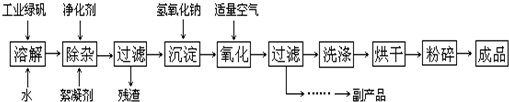
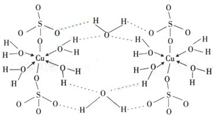
 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
 (2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.