题目内容
4、甲、乙、丙三位同学分别以铜屑为原料制取胆矾。
(1)甲同学称取6.400g铜屑,置于烧杯中,加入98%浓H2SO4,加热到铜屑完全溶解为止,然后转移到另一仪器中,浓缩、结晶。
在上述实验过程中,用到仪器有___________(填写字母编号,多选扣分)。
a.托盘天平 b.电子天平 c.坩埚 d.蒸发皿
(2)乙同学认为甲实验方案不符合“绿色化学”的理念,主要理由是此________________________。
乙同学设计如下实验方案:称取同质量铜屑放在敞口坩埚中灼烧,冷却后,加100ml某浓度稀H2SO4,使之充分反应,接下的实验操作与甲相同。若恰好反应,稀H2SO4的浓度(理论值)为_________mol/L
(3)丙同学设计如下实验方案:称取同质量铜屑,放入烧杯中,加入与上述(2)相同浓度相同体积稀H2SO4,加热,并不断通入空气,使之充分反应,接下的实验操作与甲相同。
写出上述反应的化学方程式:___________________________________________。
丙同学的实验方案优点在于_____________(填写字母编号,多选扣分)。
a.制得的胆矾纯度高 b.耗酸少,无污染 c.铜的转化率高
(4)已知胆矾在不同加热温度下有不同产物生成:
![]()
丙同学将制得的25.00g胆矾加热,结果得到灰白色的固体10.00g。经推断可知,该固体组成成份和它们的物质的量__________________________________。
答案:(1)b、d(2分)
(2)放出SO2,造成污染(2分) 1mol/L (1分)
(3) 2Cu+2H2SO4+O2→2CuSO4+2H2O (2分) b (1分)
(4)CuSO4 0.025 mol (2分) CuO 0.075 mol (2分)

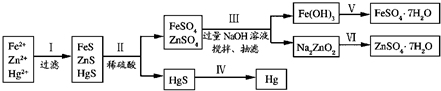
 )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案: