题目内容
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
【答案】A
【解析】
实验1加入硝酸银生成白色沉淀,说明含有Cl-、CO32-、SO42-等离子中的至少一种;实验2加足量NaOH溶液并加热,收集到标准状况下的气体1.12L,说明含有0.5molNH4+;实验3加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量,第一次称量读数为6.27g,第二次称量读数为2.33g,则说明含有CO32-、SO42-,则一定不存在Mg2+、Ba2+,且n(SO42-)=![]() =0.01mol,n(CO32-)=
=0.01mol,n(CO32-)=![]() =0.02mol,结合电荷守恒分析解答。
=0.02mol,结合电荷守恒分析解答。
根据以上分析,溶液中一定含有0.02mol CO32-、0.01mol SO42-和0.5molNH4+;一定没有Mg2+、Ba2+;溶液显电中性,根据电荷守恒,溶液中一定存在K+,可能存在Cl-。
A.溶液中一定含有的阳离子是K+、NH4+,故A正确;
B.不能确定是否含有氯离子,故B错误;
C.溶液中一定存在K+,可能存在Cl-,故C错误;
D.向实验3所得沉淀中加入盐酸时,碳酸钡被盐酸溶解,反应的离子方程式为BaCO3+2H+=H2O+CO2↑+Ba2+,故D错误;
答案选A。

【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D
【题目】用焰色反应检验K+时有如下操作步骤:①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察,④用稀盐酸洗净铂丝。其中正确的操作顺序为( )
A.①②③④
B.④①②③
C.④②①②③
D.①③②④
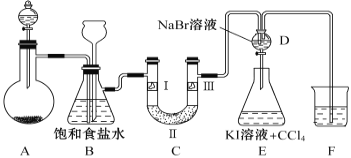
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。