题目内容
2. 实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )| 选项 | 试剂a | 试剂b | 试剂c | c中的现象 |
| A | 浓氨水 | 生石灰 | 硝酸银溶液 | 先沉淀后消失 |
| B | 稀硝酸 | 银 | 水 | 试管口无明显现象 |
| C | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 溶液颜色没有变化 |
| D | 稀硫酸 | 纯碱 | 硅酸钠溶液 | 先沉淀后消失 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓氨水滴入到生石灰上,放出的热量促进氨气的逸出,氨气与硝酸银反应先生成氢氧化银沉淀,再发生络合反应生成银氨络合物;
B.稀硝酸与银反应生成一氧化氮,一氧化氮不溶于水,易于空气反应生成二氧化氮;
C.氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性;
D.硅酸为不溶性沉淀.
解答 解:A.浓氨水滴入到生石灰上,放出的热量促进氨气的逸出,氨气与硝酸银反应先生成氢氧化银沉淀,再发生络合反应生成银氨络合物,银氨络合物为可溶性物质,所以看到现象为先产生沉淀后消失,故A正确;
B.稀硝酸与银反应生成一氧化氮,一氧化氮不溶于水,易于空气反应生成二氧化氮,二氧化氮为红棕色气体,所以看到现象为:试管口出现红棕色气体,故B错误;
C.浓盐酸与高锰酸钾反应生成氯气,氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,遇到石蕊溶液,现象为:先变红色后褪色,故C错误;
D.稀硫酸与碳酸钠反应生成二氧化碳,二氧化碳与硅酸钠溶液反应生成硅酸沉淀,现象为产生白色沉淀,故D错误;
故选A.
点评 本题考查物质的性质及实验装置的作用,熟悉物质的性质及发生的反应是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.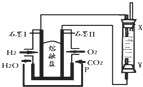 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |
13.下列解释事实的方程式正确的是( )
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
17.下列有关0.1mol•L-1NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、NH4+、CH3COOH、S2-可以大量共存 | |
| B. | 和碘水反应的离子方程式:SO32-+I2+H2O=SO42-+2I-+2H+ | |
| C. | 和足量氢氧化钡溶液反应的离子方程式:HSO3-+Ba2++OH-=BaSO3↓+H2O | |
| D. | 1L该溶液和足量稀硝酸充分反应,生成标状况下2.24LSO2 |
7.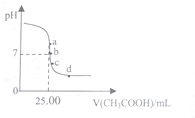 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )| A. | a点:c(CH3COONa)=0.1000 mol•L-1 | B. | b点:c(CH3COONa)=c(CH3COOH) | ||
| C. | c点:c(H+)=c(CH3COO-)+c(CH3COOH) | D. | d点:c(Na+)<c(CH3COO-)+c(CH3COOH) |
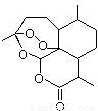
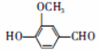 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: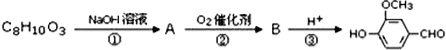
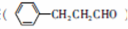 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: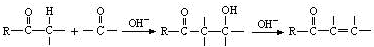
 ?H++HS-和HS-
?H++HS-和HS- Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应