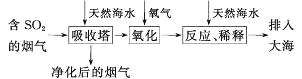
题目内容
【题目】300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1Ba(OH)2溶液300 mL(忽略溶液体积变化),反应后溶液中SO42-的物质的量浓度为
A.0.4 mol·L-1B.0.1 mol·L-1C.0.2 mol·L-1D.0.3 mol·L-1
【答案】B
【解析】
溶液中Al3+为1.62g,物质的量为1.62g÷27g/mol=0.06mol,根据电荷守恒可知,溶液中n(SO42-)=![]() ×n(Al3+)=0.09mol。加入的氢氧化钡的物质的量为0.1mol/L×0.3L=0.03mol,根据方程式SO42-+Ba2+=BaSO4↓可知SO42-剩余,剩余SO42-的物质的量为0.09mol-0.03mol=0.06mol,所以反应后溶液中SO42-的物质的量的浓度为0.06mol÷(0.3L+0.3L)=0.1mol/L,答案选B。
×n(Al3+)=0.09mol。加入的氢氧化钡的物质的量为0.1mol/L×0.3L=0.03mol,根据方程式SO42-+Ba2+=BaSO4↓可知SO42-剩余,剩余SO42-的物质的量为0.09mol-0.03mol=0.06mol,所以反应后溶液中SO42-的物质的量的浓度为0.06mol÷(0.3L+0.3L)=0.1mol/L,答案选B。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目