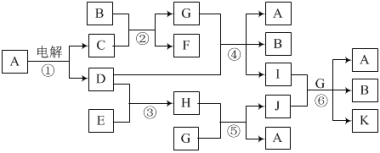
题目内容
【题目】饱和烃A和不饱和烃B在常温下均为气体,其中A含的碳原子数多于B。将A、B按一定比例混合,1L混合气体完全燃烧后在同温同压下得到3.6LCO2。
(1)试推断该混合气体的可能组成及A、B混合时的体积比,将结果填入表中。_______________________
(2)1mol该混合气体恰好能使含0.2mol溴的四氯化碳溶液完全褪色,则A和B的化学式分别为________和_________。
(3)1mol该混合气体在氧气中完全燃烧,得到68.4g水,则A和B的化学式分别为_________和__________。
(4)120℃时,1LA和1LB与足量O2混合后点燃,在同温同压下体积增大2L,则A和B的化学式分别为_________和_________。
【答案】①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2; A:C4H10 B:C2H2或C3H6; C4H10 C3H4 C4H10 C3H6
【解析】
(1)根据体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下3.6LCO2,可知混合气体的平均分子式为C3.6Hx,然后根据要想碳原子的平均值为3.6,必须有一种烃的碳原子数小于3.6,另一种烃的碳原子数大于3.6,且碳原子数若>4,那么常温下不是气体,故一种烃中最多为4个碳,据此讨论即可;
(2)如果是炔烃与溴水加成,炔应为0.2mol,如果是烯烃与溴水加成,.即烯烃应为0.4mol;
(3) 68.4g水的物质的量为![]() ,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则
,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则![]() =3.8,解得y=7.6;
=3.8,解得y=7.6;
(4)根据烃的燃烧规律:CxHy+(x+![]() y)O2
y)O2 ![]() CO2+
CO2+![]() yH2O(气),结合气体体积差量法计算平均氢原子数,得到气体的组成即可。
yH2O(气),结合气体体积差量法计算平均氢原子数,得到气体的组成即可。
(1)因1升混合气体充分燃烧后生成3.6升CO2,且A分子的碳原子数比B分子的多,混合气体只能由碳原子数大于3.6的烷烃(C4H10)和碳原子数小于3.6的烯烃或炔烃(C3H6和C2H4、C3H4和C2H2)组成.它们有四种可能的组合:C4H10、C3H6;C4H10、C2H4;C4H10、C3H4;C4H10、C2H2;根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,可确定A和B的体积比,如: ,则V(C4H10):V(C2H4)=4:1,C4H10;C3H6=3:2;②C4H10:C2H2=4:1;C4H10:C3H4=3:2,
,则V(C4H10):V(C2H4)=4:1,C4H10;C3H6=3:2;②C4H10:C2H2=4:1;C4H10:C3H4=3:2,
故答案为:①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2;
(2)如果是炔烃与溴水加成,炔应为0.2mol,因此炔烃与溴的物质的量之比为1:2,如果是烯烃与溴水加成,即烯烃应为0.4mol,烯烃与溴水物质的量之比为1:1,故答案为:A:C4H10;B:C2H2;或A:C4H10;B:C3H6;
(3) 68.4g水的物质的量为![]() ,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则
,1mol该混合气体在氧气中完全燃烧,得到68.4g水,则![]() =3.8,解得y=7.6,
=3.8,解得y=7.6,
①若为C4H10、C3H6、3:2,根据则含有氢原子![]() 不符合;
不符合;
②若为C4H10、C2H4、4:1,根据则含有氢原子![]() 不符合;
不符合;
③若为C4H10、C2H2、4:1,根据则含有氢原子![]() 不符合;
不符合;
④若为C4H10、C3H4、3:2,根据则含有氢原子![]() ,符合;
,符合;
故A和B的化学式分别为C4H10和C3H4;
(4)设1L气态烃与氧充分燃烧后体积变化为△VL,则:
CxHy+(x+![]() y)O2
y)O2 ![]() CO2+
CO2+![]() yH2O(气)△V
yH2O(气)△V
1 x+![]() 1
1 ![]()
![]() -1
-1
2L 2L
![]() =
=![]() ,解y=8,平均分子式中H原子为8个,故组合①符合题意,即A:C4H10;B:C3H6。
,解y=8,平均分子式中H原子为8个,故组合①符合题意,即A:C4H10;B:C3H6。

 阅读快车系列答案
阅读快车系列答案