题目内容
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,可在铜的催化作用下由F2和过量NH3反应得到,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3,请根据要求回答下列问题:
(1)写出制备NF3的化学反应方程式:______________________________。反应过程中,氧化剂与还原剂的物质的量之比为________。
(2)写出三氟化氮与水蒸气反应的化学方程式:______________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_____________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种钠盐:_________________________________(填化学式)。
【答案】3NF3+4NH3![]() NF3+3NH4F 3:1 3NF3+5H2O=2NO+HNO3+9HF 空气中变成红棕色,产生酸雾,同时有刺激性气味的气体产生 NaNO2、NaF、NaNO3
NF3+3NH4F 3:1 3NF3+5H2O=2NO+HNO3+9HF 空气中变成红棕色,产生酸雾,同时有刺激性气味的气体产生 NaNO2、NaF、NaNO3
【解析】
(1)3NF3+4NH3![]() NF3+3NH4F,反应过程中,4molNH3只有1mol被氧化,氧化剂与还原剂的物质的量之比为3:1;
NF3+3NH4F,反应过程中,4molNH3只有1mol被氧化,氧化剂与还原剂的物质的量之比为3:1;
(2)3NF3+5H2O=2NO+HNO3+9HF;
(3)从3NF3+5H2O=2NO+HNO3+9HF可以看出,产物中有NO,在空气中变成红棕色,HNO3会产生酸雾,同时有刺激性气味的气体产生。
(4)NaNO2、NaF、NaNO3

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】以粗硅(含硅、硼等)为原料制取四氯化硅(SiCl4)的装置示意图如下:
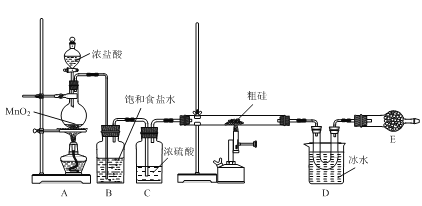
已知:①SiCl4遇水易反应;BCl3与SiCl4互溶。
②高温下硅、硼与氯气反应后所得物质的部分性质如表:
物质 | SiCl4 | BCl3 |
沸点/℃ | 57.7 | 12.8 |
熔点/℃ | -70.0 | -107.2 |
(1)装置A中盛装浓盐酸的仪器名称是___。
(2)用湿润的淀粉KI试纸可以检验Cl2,写出表示该反应原理的离子方程式:___。
(3)装置B中饱和食盐水的作用是___。
(4)装置D中收集到的物质,可用___方法分离出纯净的SiCl4。
(5)装置E中应装入的试剂名称是___,其作用有___、___。