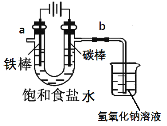
题目内容
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是_______,其价电子排布式为______。
(2)第四电离能大小:I4(Fe)> I4(Co),从原子结构的角度分析可能的原因是____。
(3)取1mol配合物CoCl3·6NH3(黄色)溶于水,加入足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为_______。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式_____;生成气体分子的中心原子杂化方式为____。
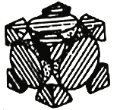
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为______(列出表达式并写出最终结果)。
【答案】第四周期VIII族 3d74s2 Fe3+电子排布较稳定的3d5变为不稳定的3d4需要更多的能量 [Co(NH3)6]3+ [Co(NH3)6]Cl3+3NaOH=Co(OH)3↓+6NH3+3NaCl sp3 面心立方堆积 ![]()
【解析】
(1)钴的原子序数为27,依据元素周期表的结构及原子核外电子排布规律作答;
(2) 根据洪特规则易知,核外电子处于半充满或全充满状态比较稳定,结合电离能的定义作答;
(3)①依据题意判断出Cl-是外界离子,不是配位体;再结合络离子形状为正八面体进行推测;
②根据以上分析,该配合物为[Co(NH3)6]Cl3,与热NaOH溶液中发生反应,放出气体应为氨气;再根据价层电子对互斥理论与杂化轨道理论结合推测其杂化方式;
(4)依据金属原子常见的堆积模型判断;根据几何关系找出晶胞立方体面对角线长为4r,若该堆积方式下的晶胞参数为acm,则(4r)2=a2+a2,再根据空间利用率=![]() 计算作答。
计算作答。
(1)钴的原子序数为27,在周期表中位于第四周期VIII族,电子排布式为1s22s22p63s23p63d74s2,其外围电子排布式为3d74s2;
故答案为:第四周期VIII族;3d74s2;
(2) Fe3+外围电子排布式为3d5,Co3+外围电子排布式为3d6,由此可知Fe3+从电子排布较稳定的3d5变为不稳定的3d4需要更多的能量,所以第四电离能大小:I4(Fe)> I4 (Co);
故答案为:Fe3+电子排布较稳定的3d5变为不稳定的3d4需要更多的能量;
(3)①1mol配合物CoCl3·6NH3(黄色)溶于水,加入足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸,说明Cl-是外界离子,不是配位离子;络离子形状为正八面体,则说明Co3+与6个NH3形成配位络离子,则络离子化学式为[Co(NH3)6]3+,
故答案为:[Co(NH3)6]3+;
②根据以上分析,该配合物为[Co(NH3)6]Cl3,与热NaOH溶液中发生反应,放出气体应为氨气,则化学方程式[Co(NH3)6]Cl3+3NaOH=Co(OH)3↓+6NH3+3NaCl;NH3分子的中心原子的价电子对数为![]() =4,故杂化方式为sp3,
=4,故杂化方式为sp3,
故答案为:[Co(NH3)6]3+;[Co(NH3)6]Cl3+3NaOH=Co(OH)3↓+6NH3+3NaCl;sp3;
(4)由图可知,该堆积方式属于面心立方堆积;
钴原子在面心立方堆积中,钴原子处于顶点和面心,该堆积方式下的晶胞参数为acm,因钴原子的半径为r,则晶胞立方体面对角线长为4r,则依据几何关系可知(4r)2=a2+a2,解得r=![]() a cm,晶胞内钴原子数目=
a cm,晶胞内钴原子数目=![]() ,则其空间利用率=
,则其空间利用率=![]() ,
,
故答案为:面心立方堆积;![]() 。
。

【题目】以粗硅(含硅、硼等)为原料制取四氯化硅(SiCl4)的装置示意图如下:
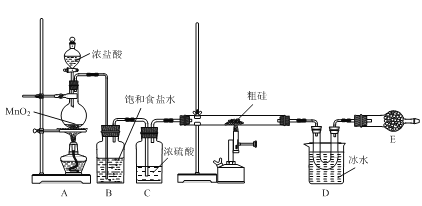
已知:①SiCl4遇水易反应;BCl3与SiCl4互溶。
②高温下硅、硼与氯气反应后所得物质的部分性质如表:
物质 | SiCl4 | BCl3 |
沸点/℃ | 57.7 | 12.8 |
熔点/℃ | -70.0 | -107.2 |
(1)装置A中盛装浓盐酸的仪器名称是___。
(2)用湿润的淀粉KI试纸可以检验Cl2,写出表示该反应原理的离子方程式:___。
(3)装置B中饱和食盐水的作用是___。
(4)装置D中收集到的物质,可用___方法分离出纯净的SiCl4。
(5)装置E中应装入的试剂名称是___,其作用有___、___。