题目内容
下列说法错误的是( )
| A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L |
| B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) |
| C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 |
| D.10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
D
解析试题分析:溶液浓度可用质量数表示也可用物质的量浓度表示,两者之间的关系为:
c=1000ρω/M,D项:经过计算浓度是相等的。
考点:化学计算
点评:熟悉质量、物质的量、物质的量浓度、质量分数、阿弗加德罗常数之间的换算关系是解决此类问题的关键。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是( )
|
如图为元素周期表中短周期的一部分,下列说法错误的是( )
| X | Y |
| Z | W |
| A、Z的原子序数可能是X的两倍 |
| B、单质的活泼性可能是Y<Z |
| C、X、Z的最高价氧化物对应水化物可能均为强酸 |
| D、分别由Y、W形成的单质可能都是原子晶体 |
化学反应原理中涉及很多常数,下列说法错误的是( )
A、反应N2(g)+3H2(g)
| |||||
| B、化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 | |||||
| C、对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 | |||||
| D、将AgNO3溶液和KCl溶液混合后,若c(Ag+)?c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
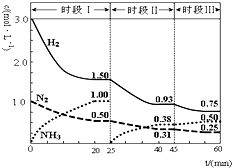 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )| A、前20分钟反应物的转化率为50% | B、第25分钟改变的条件是将NH3从反应体系中分离出去 | C、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数增大 | D、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |