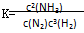题目内容
化学反应原理中涉及很多常数,下列说法错误的是( )
A、反应N2(g)+3H2(g)
| |||||
| B、化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 | |||||
| C、对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 | |||||
| D、将AgNO3溶液和KCl溶液混合后,若c(Ag+)?c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
分析:A、用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积表示平衡常数,反应N2(g)+3H2(g)
2NH3 的化学平衡常数表达式为K=
,故A正确;
B、各种常数随温度变化,化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响,故B正确;
C、温度一定电离平衡常数一定;
D、沉淀溶度积常数是饱和溶液中存在的平衡,c(Ag+)?c(Cl-)<KSP(AgCl),说明无沉淀生成;
| 催化剂 |
| 高温高压 |
| c2(NH3) |
| c(N2)c3(H2) |
B、各种常数随温度变化,化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响,故B正确;
C、温度一定电离平衡常数一定;
D、沉淀溶度积常数是饱和溶液中存在的平衡,c(Ag+)?c(Cl-)<KSP(AgCl),说明无沉淀生成;
解答:解:A、依据化学方程式和平衡常数概念书写分析判断,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
B、各种常数随温度变化;
C、对于弱电解质的电离,温度一定电离平衡常数一定,电离平衡常数越小,其酸性越弱,故C错误;
D、沉淀溶度积常数是饱和溶液中存在的平衡,c(Ag+)?c(Cl-)>KSP(AgCl)反应生成沉淀,c(Ag+)?c(Cl-)<KSP(AgCl),说明无沉淀生成,故D正确;
故选C.
B、各种常数随温度变化;
C、对于弱电解质的电离,温度一定电离平衡常数一定,电离平衡常数越小,其酸性越弱,故C错误;
D、沉淀溶度积常数是饱和溶液中存在的平衡,c(Ag+)?c(Cl-)>KSP(AgCl)反应生成沉淀,c(Ag+)?c(Cl-)<KSP(AgCl),说明无沉淀生成,故D正确;
故选C.
点评:本题考查了平衡常数的分析判断,主要是平衡常数影响因素的分析判断,掌握基础和特征是解题关键,题目较简单.

练习册系列答案
相关题目
|
化学反应原理中涉及很多常数,下列说法错误的是 | |
| [ ] | |
A. |
反应N2(g)+3H2(g) |
B. |
化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 |
C. |
对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 |
D. |
将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
化学反应原理中涉及很多常数,下列说法错误的是( )
A.反应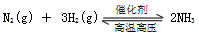 的化学平衡常数表达式为 的化学平衡常数表达式为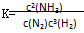 |
| B.化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 |
| C.对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 |
| D.将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |

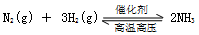 的化学平衡常数表达式为
的化学平衡常数表达式为