题目内容
如表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是( )
|
分析:A.由表中数据可知铬酸溶液中不含H2CrO4;
B.根据表中,pH和CrO42-浓度之间的关系判断;
C.溶液中存在2CrO4 2-+2H+?CrO72-+H2O,溶液在存在CrO42-、Cr2O72-之间的平衡;
D.根据相同pH下各种离子的浓度求算.
B.根据表中,pH和CrO42-浓度之间的关系判断;
C.溶液中存在2CrO4 2-+2H+?CrO72-+H2O,溶液在存在CrO42-、Cr2O72-之间的平衡;
D.根据相同pH下各种离子的浓度求算.
解答:解:A.由表中数据可知铬酸溶液中不含H2CrO4,说明铬酸的第一步电离是完全电离,则铬酸第一级电离方程式为H2CrO4=H++HCrO4-,故A错误;
B.根据表中数据知,pH越大,电离出的CrO42- 浓度越大,所以要得到CrO42-应控制溶液的pH>9,故B正确;
C.溶液中存在2CrO4 2-+2H+?CrO72-+H2O,当电离达到平衡状态时,2v逆(Cr2O72-)=v正(CrO42-),故C错误;
D.在pH=4时,c(CrO42-),=0.0003mol/L,c(HCrO4-)=0.1040mol/L,c(Cr2O72-)=0.4480mol/L,所以铬酸溶液的物质的量浓度约为1.00mol/L,故D正确;
故选AC.
B.根据表中数据知,pH越大,电离出的CrO42- 浓度越大,所以要得到CrO42-应控制溶液的pH>9,故B正确;
C.溶液中存在2CrO4 2-+2H+?CrO72-+H2O,当电离达到平衡状态时,2v逆(Cr2O72-)=v正(CrO42-),故C错误;
D.在pH=4时,c(CrO42-),=0.0003mol/L,c(HCrO4-)=0.1040mol/L,c(Cr2O72-)=0.4480mol/L,所以铬酸溶液的物质的量浓度约为1.00mol/L,故D正确;
故选AC.
点评:本题考查了弱电解质的电离,根据表中数据确定pH与各种离子浓度的关系及电解质的电离是解本题关键,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
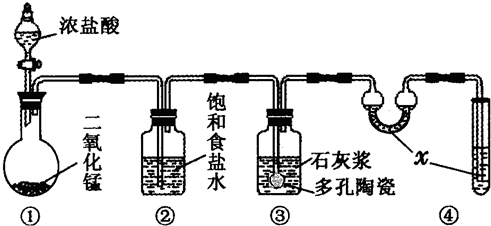
在实验室中,某研究性学习小组利用下列装置制备漂白粉,并进行有关实验探究 
(1)装置④中的x试剂为______.
(2)装置③中发生反应的化学方程式为______.该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是______.
[探究一]测定漂白粉有效成分的质量分数
称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000mol?L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2实验测得数据如下表所示.
(3)该漂白粉中有效成分的质量分数为______.若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将______(填“偏高”、“偏低”或“无影响”)
[探究二]研究漂白粉用于鱼塘消毒过程中有效氯含量的变化规律研究性学习小组模拟鱼塘环境,进行有关实验.
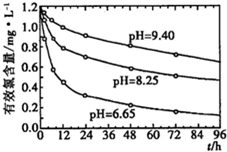
(4)研究不同的pH对漂白粉有效氯含量的影响,结果如图所示.从图中可得到的有关结论是______(写出其中一个).
(5)为研究温度对漂白粉有效氯含量的影响,请简述你的实验设计方案:______.

(1)装置④中的x试剂为______.
(2)装置③中发生反应的化学方程式为______.该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是______.
[探究一]测定漂白粉有效成分的质量分数
称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000mol?L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2实验测得数据如下表所示.
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
[探究二]研究漂白粉用于鱼塘消毒过程中有效氯含量的变化规律研究性学习小组模拟鱼塘环境,进行有关实验.
(4)研究不同的pH对漂白粉有效氯含量的影响,结果如图所示.从图中可得到的有关结论是______(写出其中一个).

(5)为研究温度对漂白粉有效氯含量的影响,请简述你的实验设计方案:______.



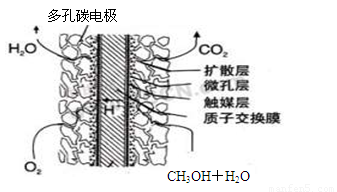
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3