题目内容
3.纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用.工业上“候氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,然后再焙烧NaHCO3制得纯碱(Na2CO3).
生产纯碱的工艺流程示意图如下:
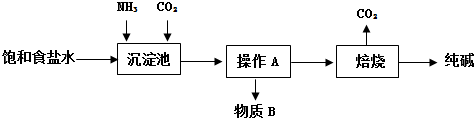
回答下列问题:
①操作A的名称为过滤.
②析出NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是取少量晶体溶于水,加稀HNO3酸化,再滴加AgNO3溶液,若产生白色沉淀,该晶体中含有氯离子.
③向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是相同温度下,碳酸钠溶解度比碳酸氢钠大.
分析 侯氏制碱法的流程是在氨化饱和的氯化钠溶液里通CO2气体,因碳酸氢钠的溶解度比碳酸钠小,有碳酸氢钠沉淀生成,经过滤、洗涤干燥后,再将碳酸氢钠加热分解可得纯碱,同时生成的CO2气体循环利用,据此分析可解答;
(1)从溶液里得到不溶物的操作是过滤;
(2)氯离子的常见检验方法是在溶液里滴加硝酸银溶液,若有白色沉淀生成,再滴加稀硝酸看沉淀有无溶解判断;
(3)在同一温度下碳酸钠的溶解度比碳酸氢钠大,故侯氏制碱法直接得到的是碳酸氢钠.
解答 解:(1)利用过滤操作可从沉淀池中得到碳酸氢钠,故答案为:过滤;
(2)检验晶体中是否有氯离子,取少量晶体溶于水,加稀HNO3酸化,再滴加AgNO3溶液,若产生白色沉淀,该晶体中含有氯离子,故答案为:取少量晶体溶于水,加稀HNO3酸化,再滴加AgNO3溶液,若产生白色沉淀,该晶体中含有氯离子;
(3)因相同温度下,碳酸钠的溶解度大于碳酸氢钠,故向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,故答案为:相同温度下,碳酸钠溶解度比碳酸氢钠大.
点评 本题考查侯氏制碱法原理分析与应用,属基础性测试题,难度不大,建议学生多关注双基的复习.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.分析下表,下列选项中错误的是( )
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7, K2=5.6×l0-11 |
| A. | CH3COO-、CO32-、CN-在溶液中可以大量共存 | |
| B. | 向食醋中加入水可使CH3COOH的电离平衡向电离方向移动 | |
| C. | 相同物质的量浓度的Na2CO3和NaCN溶液,前者pH较大 | |
| D. | pH=a的上述3种酸溶液,加水后溶液的pH相同,则醋酸中加入的水最多 |
14.在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g);△H=Q KJ/mol其化学平衡常数K和温度t的关系如下:
请回答:
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,该反应中Q>0 (选填“>”或“<”).
(2)能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变 b.反应热不变 c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)800℃,在固定容积的密闭容器中加入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.05mol/L,c(CO2)=0.01mol/L,c(H2)=0.03mol/L,反应开始时,H2O的消耗速率比生成速率大(填“大”或“小”).
(4)温度为850℃时,可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如表:
850℃时物质的浓度(mol/L)的变化
①计算:3min时CO的浓度 c1=0.08mol/L,H2O (g)的转化率=40%.
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,该反应中Q>0 (选填“>”或“<”).
(2)能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变 b.反应热不变 c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)800℃,在固定容积的密闭容器中加入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.05mol/L,c(CO2)=0.01mol/L,c(H2)=0.03mol/L,反应开始时,H2O的消耗速率比生成速率大(填“大”或“小”).
(4)温度为850℃时,可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | O.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
11.在恒温、恒容的1L密闭容器中,混合气体X、Y、Z的物质的量n与时间t 的关系如表所示:X(g)+3Y(g)?2Z(g)△H<0
(1)第6min末改变了什么条件到达第8分钟的平衡状态:通入0.35molY.
(2)在相同温度下,若1L容器为体积可变的密闭容器,现充入0.2mol X、0.6molY,达到平衡时n(Z)=bmol,则b>0.2(填“<”、“>”或“=”),平衡时容器的体积V=$\frac{4-5b}{4}$L(用含b的式子表示)
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的物质的量0.4mol
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的体积分数增大(填“增大”、“减小”或“不变”)
| t/min n/mol | 0min | 2min | 4min | 6min | 8min |
| n(X) | 0.2 | 0.15 | 0.1 | 0.1 | 0.05 |
| n(Y) | 0.6 | 0.45 | 0.3 | 0.3 | 0.5 |
| n(Z) | 0 | 0.1 | 0.2 | 0.2 | 0.3 |
(2)在相同温度下,若1L容器为体积可变的密闭容器,现充入0.2mol X、0.6molY,达到平衡时n(Z)=bmol,则b>0.2(填“<”、“>”或“=”),平衡时容器的体积V=$\frac{4-5b}{4}$L(用含b的式子表示)
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的物质的量0.4mol
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的体积分数增大(填“增大”、“减小”或“不变”)
8.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA | |
| D. | 1 mol甲基(-CH3)中含有电子的数目为10NA |
12.下列物质性质与应用对应关系正确的是( )
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 氢氧化铝胶体具有吸附性,可用于制胃酸中和剂 | |
| C. | 人缺碘就会引起碘缺乏病,我国大部分地区都缺碘,因此80年代国家强制给食用盐中加入碘单质 | |
| D. | 硅胶具有吸水性,在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 |
13.Fe3O4与HNO3反应生成Fe(NO3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是( )
| A. | 3 mol | B. | 1/2 mol | C. | 1/3 mol | D. | 9 mol |