题目内容
14.在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g);△H=Q KJ/mol其化学平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,该反应中Q>0 (选填“>”或“<”).
(2)能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变 b.反应热不变 c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)800℃,在固定容积的密闭容器中加入混合物,起始浓度为c(CO)=0.01mol/L,c(H2O)=0.05mol/L,c(CO2)=0.01mol/L,c(H2)=0.03mol/L,反应开始时,H2O的消耗速率比生成速率大(填“大”或“小”).
(4)温度为850℃时,可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | O.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
分析 (1)根据化学平衡常数的概念来书写;根据温度对化学平衡、化学平衡常数的影响来回答;
(2)化学平衡状态的标志:正逆反应速率相等,各组分的组成不变,据此判断;
(3)计算此时的浓度商Qc,与平衡常数比较判断反应进行方向,据此解答;
(4)①依据容器中浓度变化结合化学平衡的三段式列式计算,结合平衡常数不随温度变化,根据转化率公式进行计算;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.
解答 解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,
故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;>;
(2)a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、反应热是指一定物质的量的物质参加反应所产生的热效应,与反应所处状态无关,故b错误;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(CO)表明反应达到平衡状态,故c正确;
d、CO2的质量分数不变,说明反应已经处于平衡状态,故d正确;
故选cd;
(3)此时的浓度商Qc=$\frac{0.01×0.05}{0.01×0.03}$=$\frac{5}{3}$,大于800℃平衡常数0.9,故反应向逆反应进行,故H2O的消耗速率比生成速率大,
故答案为:大;
(4)①CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/mol•L-1 0.2 0.3 0 0
变化浓度/mol•L-1:c3 c3 c3 c3
平衡浓度/mol•L-1:0.2-c3 0.3-c3 c3 c3
由题意知,850℃时,K=1.0,即
K=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$=$\frac{(0.2-C{\;}_{3})×(0.3-C{\;}_{3})}{C{\;}_{3}×C{\;}_{3}}$=1.0
解得 c3=0.12mol/L,所以c1=0.08mol/L,H2O(g)的转化率=$\frac{0.12mol/L}{0.3mol/L}$×100%=40%,
故答案为:0.08;40%;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.②反应在4min~5min,平衡向逆方向移动,增大水蒸气的浓度,平衡向正反应移动,降低温度平衡向正反应移动,使用催化剂平衡不移动,增大氢气的浓度,平衡向逆反应移动,故4min~5min改变条件为增大氢气的浓度,
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,而水的浓度增大0.05mol/L,应是增大水蒸气的浓度,
故答案为:d;a.
点评 本题主要考查温度对化学平衡、化学平衡常数的影响,化学平衡常数的计算,化学平衡的标志判断,难度不大,考查学生分析和解决问题的能力.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I中CO 的物质的量比容器II中的多 | |
| C. | 容器I、III中反应的平衡常数相同 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和等于1 |
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=(a+2b-2c)kJ•mol-1.
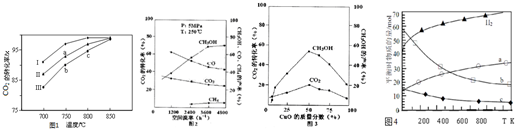
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大.
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})×{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})×{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气燃烧热为241.8 kJ•mol-1 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1;则a>b | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ |
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: