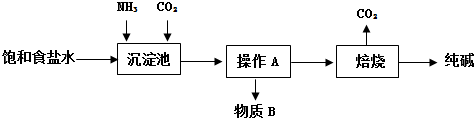
题目内容
11.在恒温、恒容的1L密闭容器中,混合气体X、Y、Z的物质的量n与时间t 的关系如表所示:X(g)+3Y(g)?2Z(g)△H<0| t/min n/mol | 0min | 2min | 4min | 6min | 8min |
| n(X) | 0.2 | 0.15 | 0.1 | 0.1 | 0.05 |
| n(Y) | 0.6 | 0.45 | 0.3 | 0.3 | 0.5 |
| n(Z) | 0 | 0.1 | 0.2 | 0.2 | 0.3 |
(2)在相同温度下,若1L容器为体积可变的密闭容器,现充入0.2mol X、0.6molY,达到平衡时n(Z)=bmol,则b>0.2(填“<”、“>”或“=”),平衡时容器的体积V=$\frac{4-5b}{4}$L(用含b的式子表示)
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的物质的量0.4mol
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的体积分数增大(填“增大”、“减小”或“不变”)
分析 (1)根据表中数据可知,反应在4min时达到平衡,可将8分钟的各物质折算成反应物,利用三段式有
X(g)+3Y(g)?2Z(g)
起始(mol) 0.2 0.6 0
8min时(mol) 0.05 0.5 0.3
折算后(mol) 0.2 0.95 0
据此判断改变的条件;
(2)当容器体积可变时,由于该反应是体积减小的反应,所以平衡时压强大于恒容时压强,则平衡正向移动,
根据三段式
X(g)+3Y(g)?2Z(g)
起始(mol) 0.2 0.6 0
8min时(mol) 0.5b 1.5b b
平衡(mol) 0.2-0.5b 0.6-1.5b b
根据体积之比等于物质的量之比计算;
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡与原平衡为等效平衡,据此计算Z的物质的量;
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,相当于对原平衡体系加压,平衡向正反应方向移动,据此判断Z的体积分数;
解答 解:(1)根据表中数据可知,反应在4min时达到平衡,可将8分钟的各物质折算成反应物,利用三段式有
X(g)+3Y(g)?2Z(g)
起始(mol) 0.2 0.6 0
8min时(mol) 0.05 0.5 0.3
折算后(mol) 0.2 0.95 0
比较上面的数据可知,Y增加了0.95mol-0.6mol=0.35mol,所以第6min末通入0.35mol Y到达第8分钟的平衡状态,
故答案为:通入0.35mol Y;
(2)当容器体积可变时,由于该反应是体积减小的反应,所以平衡时压强大于恒容时压强,则平衡正向移动,所以b>0.2,
根据三段式
X(g)+3Y(g)?2Z(g)
起始(mol) 0.2 0.6 0
8min时(mol) 0.5b 1.5b b
平衡(mol) 0.2-0.5b 0.6-1.5b b
所以平衡时容器的体积V=$\frac{0.2-0.5b+0.6-1.5b+b}{0.2+0.6}$L=$\frac{4-5b}{4}$L,
故答案为:>;$\frac{4-5b}{4}$L;
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡与原平衡为等效平衡,所以Z的物质的量为原来的2倍,即为0.4mol,
故答案为:0.4mol;
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,相当于对原平衡体系加压,平衡向正反应方向移动,所以Z的体积分数增大,
故答案为:增大.
点评 本题考查了化学平衡影响因素分析判断、等效平衡,掌握基础是解题关键,注意影响因素的理解应用,题目难度中等.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
| A. | S(s,单斜)=S(s,正交)△H=+0.33kJ/mol | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量 |
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=(a+2b-2c)kJ•mol-1.
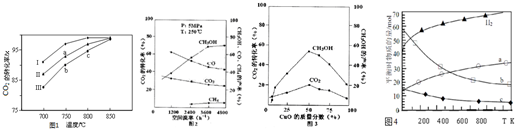
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大.
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})×{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})×{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气燃烧热为241.8 kJ•mol-1 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1;则a>b | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ |
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=c/mol•L-1
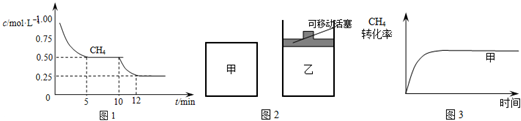
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L.min);10min时,改变的外界条件可能是降低温度.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
①0.05mol/L H2SO3溶液的pH>1,
②常温下Na2SO3溶液的pH>7,
③H2SO3不稳定,易分解,
④H2SO3能与碳酸钠反应制CO2,
⑤H2SO3能和水以任意比例互溶,
⑥1mol H2SO3能够消耗2molNaOH.
| A. | ①②⑤ | B. | ①②④ | C. | ①②③⑤ | D. | ①② |
| A. | 1 L 0.1mol•L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol | |
| B. | 4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 | |
| C. | 在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 | |
| D. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |