题目内容
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.已知: ① 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
②H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
由知断开1mol H-H键所需能量为436kJ;断开1molO=O键所需能量为496kJ;断开1molCl-Cl键所需能量为243KJ。则
(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1molH-O键所需能量为 kJ。
Ⅱ.已知: CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol-1 ①
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol-1 ②
又知CH4的燃烧热为890.3kJ/mol。
(1)利用上述已知条件写出甲烷完全燃烧的热化学方程式: 。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
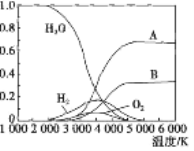
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中B表示的微粒是_______(填名称),等质量的A、H2化学能较低的物质是_______(填化学式)。
【答案】
Ⅰ.(1)2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1;(2)462.9;
Ⅱ.(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
(2)CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1;
(3)氧原子;H2。
【解析】
试题分析:Ⅰ.(1)①+②×2,整理可得2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1;(2)断裂反应物的化学键吸收的键能与形成生成物时产生的化学键的键能的差就是反应的反应热,则2×436kJ/mol + 496kJ/mol-4×H-O=483.6 kJ/mol,解得H-O=462.9kJ/mol;Ⅱ.(1) CH4的燃烧热为890.3kJ/mol,表示1mol氢气完全燃烧产生CO2和液态水,反应的热化学方程式是:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;(2) ①×2+②,整理可得:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1;(3) 由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子。分子断裂化学键吸收能量转化为单个的原子,所以等质量的H原子、H2化学能较低的物质是H2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案