题目内容
7.下列关于化学的认识说法不正确的是( )| A. | 化学是在原子、分子水平上研究物质的组成和性质等 | |
| B. | 化学在能源和资源的合理利用等方面有着重要作用 | |
| C. | 化学是一门对人类生产和生活有着重要作用的实用学科 | |
| D. | 随着现代技术的发展,理论研究可以逐渐代替实验手段 |
分析 A.化学就是在原子、分子水平上研究物质的组成、结构、性质及其变化规律的一门基础自然科学;
B.化学研究能量的变化;
C.化学是一门实用的学科;
D.化学以实验为基础.
解答 解:A.化学就是在原子、分子水平上研究物质的组成、结构、性质及其变化规律的科学,故A正确;
B.合理地开发和利用能源和资源属于化学研究的范畴,故B正确;
C.化学是一门实用的学科,生活中的许多问题常涉及到化学知识,故C正确;
D.化学以实验为基础,理论不能代替实验,故D错误.
故选D.
点评 本题考查了化学的主要研究领域,包括四个方面,物质的组成、结构、性质、变化规律等知识点,题目难度不大.

练习册系列答案
相关题目
17.碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性.其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 | |
| C. | 高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀 |
18.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$滴加$\stackrel{硝酸钡溶液}{→}$白色沉淀滴加$\stackrel{稀盐酸}{→}$沉淀不溶解-→说明试样已变质 | |
| B. | 除去粗盐中硫酸钙杂质:粗盐$\stackrel{溶解}{→}$足量$\stackrel{碳酸钠溶液}{→}$足量$\stackrel{氯化钡}{→}$溶液$\stackrel{过滤}{→}$滤液中$\stackrel{滴加}{→}$盐酸$\stackrel{结晶}{→}$精盐 | |
| C. | 检验某溶液中是否含有Fe2+试样$\stackrel{KSCN溶液}{→}$溶液颜色无变化$\stackrel{滴加氨水}{→}$溶液变红色-→溶液中含有Fe2+ | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液30%$\stackrel{H_{2}O_{2}}{→}$稀硝酸$\stackrel{淀粉}{→}$溶液变蓝色-→氧化性:H2O2>I2 |
15.下列变化属于物理变化的是( )
| A. | 石油的裂化 | B. | 石油裂解 | C. | 石油的分馏 | D. | 古代植物变成煤 |
2.下列反应的离子方程式书写正确的是( )
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 用 CH3COOH 溶解 CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 甲烷与氯气光照生成一氯甲烷:CH4+Cl2→CH3Cl+H++Cl- | |
| D. | 铜溶解于氯化铁溶液中:2Fe3++Cu═2Fe2++Cu2+ |
12.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
4.乙酰水杨酸即阿斯匹林(aspirin)是一种解热止痛、治疗感冒药,实验室制取原理为:

实验方法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g 0.053mol),滴入5滴浓硫酸,在70℃反应一段时间,按如下流程分离出乙酰水杨酸.
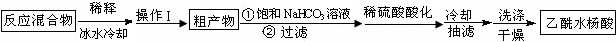
已知:①乙酰水杨酸溶于热水,在冷水中微溶;乙酸酐遇水生成乙酸.饱和NaHCO3溶液
②乙酰水杨酸钡、水杨酸钡均可溶于水.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
(5)产率计算:称量干燥后纯净产品质量为3.2g,该实验中乙酰水杨酸的产率计算表达式为$\frac{3.2}{0.045×180}$×100%,计算结果为40%(保留两位有效数字).(乙酰水杨酸的相对分子质量为180)

实验方法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g 0.053mol),滴入5滴浓硫酸,在70℃反应一段时间,按如下流程分离出乙酰水杨酸.
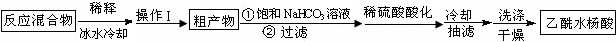
已知:①乙酰水杨酸溶于热水,在冷水中微溶;乙酸酐遇水生成乙酸.饱和NaHCO3溶液
②乙酰水杨酸钡、水杨酸钡均可溶于水.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中,加入少量BaCl2溶液(或取试管B中溶液做焰色反应实验). 此空删去.此空删去 | 无白色沉淀生成 | 产品中不含SO42- |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). 此空删去.此空删去 | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
 回答下列问题:
回答下列问题: