题目内容
7.某密闭容器中有100g氧气和足量的过氧化钠,向其中充入5g CO和H2的混合气体后,用电火花点燃,反应足够长时间后,容器内气体的质量为100g.分析 由2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,可得总反应为:CO+Na2O2=Na2CO3,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,可得总反应为:H2+Na2O2=2NaOH,故反应容器内氧气质量不变.
解答 解:由2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,可得总反应为:CO+Na2O2=Na2CO3,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,可得总反应为:H2+Na2O2=2NaOH,故反应容器内氧气质量不变,即容器内气体的质量为100g,故答案为:100g.
点评 本题考查化学方程式有关计算,侧重解题方法技巧的考查,注意利用总反应方程式解答,难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
18.下列透明且呈酸性的溶液中能大量共存的是( )
| A. | K+,Cu2+,Cl-,SO42- | B. | NO3-,Mg2+,S2-,SO42- | ||
| C. | HCO3-,I-,Ca2+,Cl- | D. | K+,Ca2+,CO32-,Cl- |
15.化学与生活密切相关,下列有关说法正确的是( )
| A. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| B. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| C. | 苯酚有一定毒性,不能作消毒剂和防腐剂 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
12.燃烧热是指通常状况下1mol纯物质完全燃烧生成稳定的化合物所放出的热量,下列说法正确的是( )
| A. | 通常状况下,1g氢气燃烧生成液态水时放出142.9kJ的热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| B. | 已知H2(g)+F2(g)═2HF(g),△H=-270kJ/mol,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),△H=-38.6kJ/mol | |
| D. | 已知:①C(s石墨)+O2(g)═CO2(g),△H=-393.5kJ/mol,②C(s,金刚石)+O2(g)═CO2(g),△H=-395.0kJ/mol,则C(s,金刚石)═C(s,石墨),△H=-1.5kJ/mol |
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等质量的丙烯(C3H6)和环丁烷(C4H8)所含有的原子数一定相等 | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 将5.85g NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA |
16.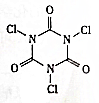 三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )
 三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂.三氯异氰尿酸水解生成X和NH4HCO3.下列关于X的说法不正确的是( )| A. | X的结构式为H-Cl-O | B. | X有强氧化性 | ||
| C. | X属于弱酸 | D. | X属于电解质 |
1.科学家将${\;}_{30}^{66}$Zn和${\;}_{82}^{208}$Pb两原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267.下列有关该元素的说法正确的是( )
| A. | 位于第七周期第Ⅷ族 | |
| B. | 具有“两性” | |
| C. | 原子核外共有6个电子层 | |
| D. | 该原子中,中子数与质子数之差为43 |
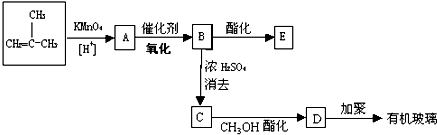
 C
C E
E
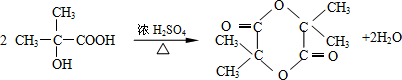 ;
;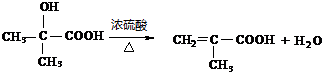 ;
;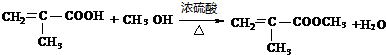 .
.