题目内容
1.科学家将${\;}_{30}^{66}$Zn和${\;}_{82}^{208}$Pb两原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267.下列有关该元素的说法正确的是( )| A. | 位于第七周期第Ⅷ族 | |
| B. | 具有“两性” | |
| C. | 原子核外共有6个电子层 | |
| D. | 该原子中,中子数与质子数之差为43 |
分析 A.根据在周期表中的位置判断,112号元素位于第七周期第IIB族;
B.根据金属性的递变规律分析;
C.根据112号元素原子核外有7个电子层分析;
D.元素左上角数字为质量数,左下角为质子数,根据质子数+中子数=质量数进行判断.
解答 解:A.根据第七周期0族元素的原子序数为118,则112号元素位于第七周期第IIB族,故A错误;
B.同主族元素从上到下元素的金属性逐渐增强,则该元素应具有较强的金属性,不具有两性,故B错误;
C.根据第七周期0族元素的原子序数为118,则112号元素该原子核外有7个电子层,故C错误;
D.该原子中中子数=267-112=155,中子数与质子数之差=1455-112=43,故D正确;
故选D.
点评 本题考查了元素在周期表中的位置、质子数和中子数的关系等知识点,同时考查学生对基础知识的掌握程度,注意元素左上角数字为质量数,左下角为质子数,质子数+中子数=质量数,根据原子结构确定元素在周期表中的位置是解答关键,题目难度不大.

练习册系列答案
相关题目
12.在强酸性无色溶液中,能大量共存的离子组是( )
| A. | Al3+、MnO4-、SO42-、Cl- | B. | Ba2+、K+、OH-、Cl- | ||
| C. | NH4+、Mg2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CH3COO- |
16.下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | MgBr2的形成过程用电子式表示为: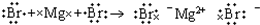 | D. | Cl-的结构示意图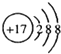 |
6.下列操作中仪器使用不正确的是( )
| A. | 用碱式滴定管盛装高锰酸钾溶液 | B. | 用铁坩埚灼烧烧碱 | ||
| C. | 用铁坩埚除去纯碱晶体中的结晶水 | D. | 加热蒸发皿时不用石棉网 |
13.已知反应2HBr(g)?Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
下列说法正确的是( )
| 实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 从上表数据分析,2HBr?Br2+H2正反应为放热反应 | |
| B. | 实验2中HBr的初始浓度C2=1.0 mol/L | |
| C. | 实验3的反应速率小于实验1的反应速率 | |
| D. | 实验4一定使用了催化剂 |
11.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐.

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 | |
| B. | 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3 | |
| C. | B和Cl2的反应是氧化还原反应 | |
| D. | 当X是强酸时,C在常温下是气态单质 |
 .
. ;如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3 -.
;如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3 -.
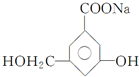 、
、 、
、 .
.