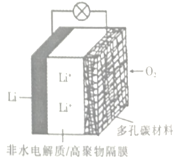
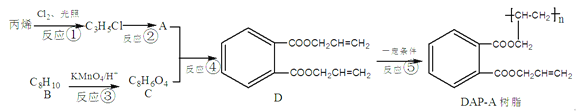
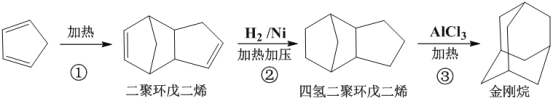
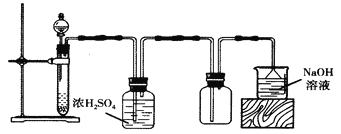
题目内容
【题目】0.2 mol某有机物在充有0.4 mol氧气的密闭容器中燃烧.产物为CO2、CO、H2O(g)组成的混合气。将该混合气依次缓慢通过浓硫酸、灼热的CuO、碱石灰,充分作用,浓硫酸增重10.8 g、CuO失重3.2 g、碱石灰增重17.6 g。
(1)请通过计算,推断该有机物的分子式_______________
(2)该有机物能与金属钠发生反应产生气体,写出可能的结构简式__________。
【答案】根据题意,燃烧产物中: n(H2O)=0.6 mol, n(CO)=0.2 mol, n(CO2)=0.2 mol,0.2mol有机物: n(H)=1.2 mol, n(C)=0.4 mol,n(O)=0.4 mol,有机物的分子式:C2H6O2 HOCH2CH2OH、 CH3OCH2OH
【解析】
浓硫酸具有吸水性,浓硫酸的质量增加10.8g为燃烧生成水的质量。通过灼热氧化铜,由于发生反应CuO+CO![]() Cu+CO2使固体的质量减轻,利用差量法可计算CO的质量。通过碱石灰时,碱石灰的质量增加了17.6g为CO2的总质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据n=
Cu+CO2使固体的质量减轻,利用差量法可计算CO的质量。通过碱石灰时,碱石灰的质量增加了17.6g为CO2的总质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据n=![]() 计算各物质的物质的量。
计算各物质的物质的量。
(1)根据元素守恒计算有机物中C、H、O原子数目,进而求得化学式;
(2)分子中含有-OH,结合分子式据此书写结构简式;
(1)有机物燃烧生成水10.8g,其物质的量=![]() =0.6mol,令有机物燃烧生成的CO为x,则:CuO+CO
=0.6mol,令有机物燃烧生成的CO为x,则:CuO+CO![]() Cu+CO2,每有28gCO参加反应,固体质量减少16g,CuO失重3.2 g,所以m(CO)=
Cu+CO2,每有28gCO参加反应,固体质量减少16g,CuO失重3.2 g,所以m(CO)=![]() =5.6g,CO的物质的量=
=5.6g,CO的物质的量=![]() =0.2mol。根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g·mol-1=8.8g,有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为
=0.2mol。根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g·mol-1=8.8g,有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为![]() =0.2mol,根据碳元素守恒可知,有机物分子中含有碳原子数目=
=0.2mol,根据碳元素守恒可知,有机物分子中含有碳原子数目=![]() =2,含有氢原子数目=
=2,含有氢原子数目=![]() =6,0.2mol有机物分子含有O原子物质的量=(0.6mol+0.2mol+0.2mol×2-0.4mol×2)=0.4mol,故分子中含有O原子数目=
=6,0.2mol有机物分子含有O原子物质的量=(0.6mol+0.2mol+0.2mol×2-0.4mol×2)=0.4mol,故分子中含有O原子数目=![]() =2,所以有机物的分子式为C2H6O2,故答案为:C2H6O2;
=2,所以有机物的分子式为C2H6O2,故答案为:C2H6O2;
(2)有机物能与金属钠发生反应产生气体,分子中含有-OH,可能有1个或2个羟基,可能的结构简式:HOCH2CH2OH、CH3OCH2OH,故答案为:结构简式: HOCH2CH2OH、CH3OCH2OH。

 备战中考寒假系列答案
备战中考寒假系列答案