题目内容
【题目】以绿矾(主要成分FeSO4·7H2O,部分Fe2+已被氧化为Fe3+)为原料,生产铁红(Fe2O3)的工艺流程如下:
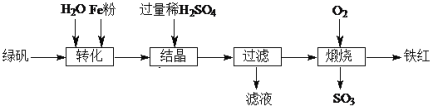
(1)“转化”过程中,加入Fe粉时发生反应的离子方程式为____;为提高该反应速率可采取的措施有:____、____。
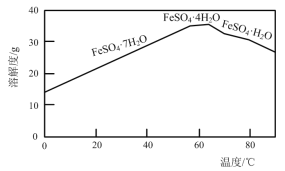
(2)“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是____(填化学式)。
(3)“滤液”的主要成分为FeSO4、____(填化学式)。利用该滤液将工业废水中的Cr2O72—还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3,理论上完全反应消耗的n(FeSO4)∶n(Cr2O72—) =____。
(4)“煅烧”时生成铁红的化学方程式为____。
【答案】Fe+2Fe3+=3Fe2+ 搅拌 升高温度、研碎等 FeSO4·H2O H2SO4 6:1 4[FeSO4·H2O]+O2![]() 2Fe2O3+4SO3+4H2O
2Fe2O3+4SO3+4H2O
【解析】
绿矾溶于水后有铁离子,铁离子加入铁粉后变为亚铁离子,加入过量稀硫酸,控制温度析出FeSO4·H2O,在氧气中煅烧得到氧化铁。
⑴“转化”过程中,由于溶液中有部分铁离子,加入Fe粉时发生反应生成亚铁离子,其离子方程式为Fe+2Fe3+=3Fe2+;为提高该反应速率可采取的措施有:升高温度、搅拌、研碎等方法,
故答案为:Fe+2Fe3+=3Fe2+;搅拌;升高温度、研碎等;
⑵“结晶”时,根据溶解度曲线图,控制温度在75℃左右进行,从溶液中析出的晶体是FeSO4·H2O,
故答案为:FeSO4·H2O;
⑶“滤液”的主要成分为FeSO4、H2SO4。利用该滤液将工业废水中的Cr2O72-还原为Cr3+,亚铁化合价升高到铁离子,铁升高1价,重铬酸根离子降低6价,根据得失电子守恒,理论上完全反应消耗的n(FeSO4)∶n(Cr2O72-) = 6:1。
⑷“煅烧”时FeSO4·H2O在氧气中反应生成铁红,发生氧化还原反应,其反应的化学方程式为
4[FeSO4·H2O]+O2![]() 2Fe2O3+4SO3+4H2O,
2Fe2O3+4SO3+4H2O,
故答案为:4[FeSO4·H2O]+O2![]() 2Fe2O3+4SO3+4H2O。
2Fe2O3+4SO3+4H2O。

【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。