题目内容
【题目】(某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
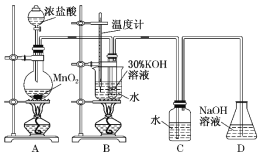
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有________。
(2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是________________。
②设计1号试管实验的作用是________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为___________________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__________________________。(不考虑实验装置及操作失误导致不可行的原因)
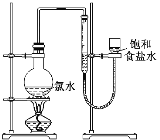
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______________________________________________________________________。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-。
【答案】(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可)(2)能(3)①研究反应体系中硫酸浓度对反应产物的影响;②硫酸浓度为0的对照实验 ③ClO3-+6I-+6H+=Cl-+3I2+3H2O(4)因存在Cl2的重新溶解、HClO分解等,此方案无法测定试样含氯总量(或其他合理答案)(5)量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量(或其他合理答案)
【解析】
试题(1)制取实验结束后,由取出B中试管进行的操作(冷却结晶、过滤、洗涤),可知该实验操作过程中需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管,故答案为:烧杯、漏斗、玻璃棒、胶头滴管;
(2)Cl2与热的KOH溶液反应生成KClO3、KCl和H2O,与冷的KOH溶液反应生成KClO、KCl和H2O。因此,若将装置B、C的位置对调,可以除去Cl2中的杂质气体HCl,故能提高B中KClO3的产率,故答案为:能;
(3)①根据表格中的数据可知:KI、KClO3的物质的量及浓度不变,改变的是硫酸溶液的体积和水的多少,二者的总体积相等,由此可见系列a实验的目的是研究反应体系中硫酸浓度对反应产物的影响,故答案为:研究反应体系中硫酸浓度对反应产物的影响;
②设计1号试管实验的作用是作对照实验,比较影响结果,故答案为:硫酸浓度为0的对照实验;
③根据2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色,证明生成了I2;若氧化产物唯一,还原产物为KCl,根据氧化还原反应中电子守恒、电荷守恒及元素原子守恒可知该反应的离子方程式为:ClO3-+6I-+6H+===Cl-+3I2+3H2O,故答案为:ClO3-+6I-+6H+=Cl-+3I2+3H2O;
(4)该小组设计的实验方案不可行的主要原因是溶液中存在Cl2的重新溶解以及HClO分解生成HCl和O2等,无法测定试样含氯总量,故答案为:因存在Cl2的重新溶解、HClO分解等,此方案无法测定试样含氯总量;
(5)由于HClO具有强氧化性会破坏酸碱指示剂,因此实验设计时不能用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,H2O2把氯元素完全还原为Cl-,H2O2被氧化成O2,然后加热除去过量的H2O2,冷却,再加入足量的AgNO3溶液,过滤、洗涤生成的AgCl沉淀,干燥后称量沉淀质量,结合氯原子守恒即可确定其中含有的氯元素的质量,故答案为:量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量。