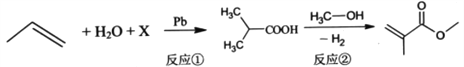
��Ŀ����
����Ŀ��ij��ȤС�����������ʵ��װ�ã�ʵ��ʱ���ȶϿ�K2 �� �պ�K1 �� �����������ݲ�����һ��ʱ��Ͽ�K1 �� �պ�K2 �� ���ֵ�����ָ��ƫת�������й�������ȷ���ǣ������� 
A.�Ͽ�K2 �� �պ�K1ʱ���ܷ�Ӧ�����ӷ���ʽΪ��2H++2Cl�� ![]() Cl2��+H2��
Cl2��+H2��
B.�Ͽ�K2 �� �պ�K1ʱ��ʯī�缫������Һ���
C.�Ͽ�K1 �� �պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ��Cl2+2e��=2Cl��
D.�Ͽ�K1 �� �պ�K2ʱ��ʯī�缫������
���𰸡�D
���������⣺A���Ͽ�K2���պ�K1ʱ���ǵ���װ�ã���ⱥ��ʳ��ˮ���ܷ�Ӧ�����ӷ���ʽΪ2H2O+2Cl�� ![]() Cl2��+H2��+2OH������A����
Cl2��+H2��+2OH������A����
B���Ͽ�K2���պ�K1ʱ���ǵ���װ�ã������������ݲ�����˵����������������ֱ�����������������˻��ý���Cu������������Cu��������ʯī�������������ϣ�ʯī�缫�ϣ�����������ʧ���ӷ���������Ӧ�������ϣ�Cu�缫�ϣ������ӵõ����ӷ�����ԭ��Ӧ������ˮ�ĵ���ƽ�⣬����������Ũ�������̪��죻��B����
C���Ͽ�K1���պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ���γ�����ȼ�ϵ�أ�������������֪��Cu�缫�ϲ�����������ʯī�缫�ϲ��������������ͭ����������������Ӧ������ʧ�������������ӵķ�Ӧ����C����
D���Ͽ�K1���պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ���γ�����ȼ�ϵ�أ�ʯī�缫�ϲ���������������ԭ�����������D��ȷ��
��ѡD��
A���Ͽ�K2���պ�K1ʱ���ǵ���װ�ã������������ݲ�����˵����������������ֱ�����������������˻��ý���Cu������������
B���Ͽ�K2���պ�K1ʱ���ǵ���װ�ã������������ݲ�����ʯī����������Һ������������ʧ���ӷ���������Ӧ��ͭ�������������ӵõ����ӷ�����ԭ��Ӧ������ˮ�ĵ���ƽ�⣬����������Ũ������
C���Ͽ�K1���պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ���γ�����ȼ�ϵ�أ�ͭ����������ʧ���ӷ���������Ӧ��
D���Ͽ�K1���պ�K2ʱ�����ֵ�����ָ��ƫת��֤����ԭ��ط�Ӧ��ʯī��ԭ���������

����Ŀ��ijѧ����0.1000molL��1�������Һ�ⶨij�ռ���Ʒ�Ĵ��ȣ����ʲ������ᷴӦ����ʵ�鲽�����£�
��1�����ƴ���Һ����2.50g�����������ʵĹ����ռ���Ʒ����500mL��Һ�����õIJ������������ձ�����ͷ�ιܡ��������⣬����Ҫ ��
��2���ζ��� I��������ˮϴ����ʽ�ζ��ܣ�������ע���������Һ����0���̶�������
�̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壬����Һ������0����0���̶������£�����¼����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������2�η�̪��Һ
�����ñ�Һ�ζ����յ㣬��¼�ζ���Һ�������
�������ζ��������д�����ǣ����ţ� �� �ô�������ᵼ�²ⶨ������ƫ����ƫС������Ӱ�족����
�ڲ�����еζ�ʱ�۾�Ӧ���жϵζ��յ�������� ��
��������II�����Ӷ�����������и��Ӷ��������ʹ�ⶨ������ƫ����ƫС������Ӱ�족����
��3������ȷ��������й����ݼ�¼���£�
�ζ����� | ����Һ��� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 20.00 | 0.20 | 20.38 |
�ڶ��� | 20.00 | 4.00 | 24.20 |
������ | 20.00 | 2.38 | a |
��a�Ķ�����ͼ��ʾ����a=��
���ռ���Ʒ�Ĵ���Ϊ%��
����Ŀ��������(Y)������Ҫ�Ĺ�����ֵ��������ȿ����ѱ��ٿݽߡ�ͨ������������ʯ���Եõ�Y3+�Ľ���Һ��
��1 ����Һ�ɷ�
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
Ũ��/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
��1������Һ�����л��ܼ���HR��������ȡ��ʵ��Y3+�ĸ�������֪��Y3+��Fe3+�������ƣ���ԭ�����£�Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ ����֪��FeR3��YR3��������HR��
YR3 + 3H+ ����֪��FeR3��YR3��������HR��
����Һ�ڲ�ͬpH����ȡ�Ľ����ͼ1��

���û�ѧƽ��ԭ�����ͣ���pH����Y3+��ȡ�������ԭ��________��
�ڽ��ͼ1���ͣ���ҵ����ȡY3+֮ǰ��Ӧ���ȳ�ȥFe3+��ԭ����________��
��2���������кͳ��������������ᷨ�����Գ�����
��2 Fe3+��Y3+ȥ����
�յ�pH | ȥ����/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
�кͳ������������Һ�м���NaOH��Fe3+��ȥ�������2��ʾ��
�ٸ�ʵ�������£�Fe3+ȥ���ʱ�Y3+��Ŀ���ԭ��________��
���ᷨ�������ᣨH3PO4����Ԫ���ᣩ���뵽����Һ�У��ټ���Na2CO3��Һ����pHΪ2.5�����˳�ȥ������������FePO4������Һ��ʣ���Fe3+��Y3+Ũ�����3��
��3 ��Һ��Fe3+��Y3+��Ũ��
Fe3+ | Y3+ | |
Ũ��/(mgL-1) | 508 | 68.9 |
�� ��ƽ�����ᷨ�����������е����ӷ���ʽ
Fe3+ + + = FePO4��+ CO2��+ ��___________________
�� �ۺϷ�����1����2����3����ҵ�ϲ��������ᷨ��������ԭ��________��
��3���������ᷨ�����������л��ܼ�HR��ȡY3+����ͨ��________����������ռ���Y3+���л���Һ��
��4���ۺϷ������ϲ��ϣ�����˵����������________��
a. ����ͼ1��֪��pH��0.2��2.0��Χ�ڣ��л��ܼ��е�Fe3+����ˮ��Һ�е�Fe3+
b. ��2�� Y3+��ʧ����20%���ҵ�ԭ����������ɵ�Fe(OH)3��Y3+������
c. ��2�� pH��4.5��5.0��Χ�ڣ�Y3+��ʧ�ʱ��Ŀ���ԭ��Y3+ + 3OH- = Y��OH��3��
d. �л��ܼ���ȡY3+���ŵ���Ca2+��Mg2+��Mn2+�Ƚ���������ȡ�ʼ���