��Ŀ����
����Ŀ��ijѧ����0.1000molL��1�������Һ�ⶨij�ռ���Ʒ�Ĵ��ȣ����ʲ������ᷴӦ����ʵ�鲽�����£�
��1�����ƴ���Һ����2.50g�����������ʵĹ����ռ���Ʒ����500mL��Һ�����õIJ������������ձ�����ͷ�ιܡ��������⣬����Ҫ ��
��2���ζ��� I��������ˮϴ����ʽ�ζ��ܣ�������ע���������Һ����0���̶�������
�̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壬����Һ������0����0���̶������£�����¼����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������2�η�̪��Һ
�����ñ�Һ�ζ����յ㣬��¼�ζ���Һ�������
�������ζ��������д�����ǣ����ţ� �� �ô�������ᵼ�²ⶨ������ƫ����ƫС������Ӱ�족����
�ڲ�����еζ�ʱ�۾�Ӧ���жϵζ��յ�������� ��
��������II�����Ӷ�����������и��Ӷ��������ʹ�ⶨ������ƫ����ƫС������Ӱ�족����
��3������ȷ��������й����ݼ�¼���£�
�ζ����� | ����Һ��� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 20.00 | 0.20 | 20.38 |
�ڶ��� | 20.00 | 4.00 | 24.20 |
������ | 20.00 | 2.38 | a |
��a�Ķ�����ͼ��ʾ����a=��
���ռ���Ʒ�Ĵ���Ϊ%��
���𰸡�
��1��500mL����ƿ����Ͳ
��2����ƫ��ע����ƿ����Һ��ɫ�ı仯����Һ�ɺ�ɫ�պñ�Ϊ��ɫ,�Ұ�����ڲ���ɫ��ƫС
��3��22.60��80.8
���������⣺��1����2.50g�����������ʵĹ����ռ���Ʒ����500mL��Һ�����ƹ���Ϊ�����㡢�������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ�ҡ�ȵȣ���Ҫ��������������ƽ���ձ�������������Ͳ��500mL����ƿ����ͷ�ιܣ����õIJ������������ձ�����ͷ�ιܡ��������⣬����Ҫ��Ͳ��500mL����ƿ��
���Դ��ǣ�500mL����ƿ����Ͳ����2����������ˮϴ����ʽ�ζ��ܣ�Ȼ��������ʽ�ζ����ñ�Һ������ϴ������ᵼ�±�ҺŨ�ȼ�С���õ�ʱ���ĵı�Һ������ⶨ���ƫ��
���Դ��ǣ��� ƫ�ڵζ�ʱ˫��Ӧע��۲���ƿ����Һ��ɫ�ı仯����ƿ�е����̪����ҺΪ��ɫ�����ŷ�Ӧ���У�����������������ǡ�÷�Ӧ����Һ����ɫ����ʧ�����Դﵽ�յ�����Ϊ����Һ��ɫ��ȥ����30���ڲ���ɫ��
���Դ��ǣ��۲���ƿ����Һ��ɫ�ı仯����Һ��ɫ��ȥ���Ұ�����ڲ���ɫ���۲���II�����Ӷ������ᵼ�µζ��ܵĶ���ƫ������и��Ӷ������ᵼ�µζ��ܶ���ƫС�����յ������ĵ��������ƫС���ⶨ���ƫ�ͣ�
���Դ��ǣ�ƫС����3������������������ֱ�Ϊ��20.38mL��0.20mL=20.18mL��24.20mL��4.00mL=20.20mL��a=22.6mL��22.6mL��2.38mL=20.22mL�����εζ����ݶ�����Ч�ģ��������������ƽ�����Ϊ�� ![]() =20.20mL��
=20.20mL��
���ݹ�ϵʽNaOH��HCl��֪��n��NaOH��=n��HCl��=0.1000molL��1��0.022mL=0.00202mol��
����20.00mL������Һ���У�m���ռ�TnM�T0.00202mol��40g/mol=0.808g��
����1000mL������Һ����m���ռ�T0.808g�� ![]() =2.02g��
=2.02g��
�ռ�Ĵ��Ȧأ��ռ= ![]() ��100%=80.8%��
��100%=80.8%��
���Դ��ǣ�22.60��80.8%��

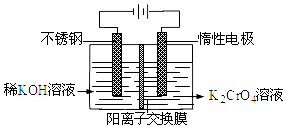
 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�������ǻ������������ֺ������绢������������������Ϊ���Ͻ��ά���������ӷϷ�(��Ҫ�ɷ�ΪV2O5��Fe2O3��SiO2��)�л���V2O5��һ�ֹ�����������ͼ��ʾ: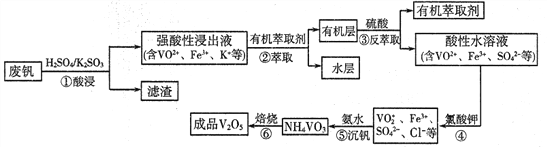
��֪:�����������еı仯���̿ɼ�Ϊ:Rn+(ˮ��)+nHA(�л���)![]() RAn(�л���)+nH+(ˮ��)(ʽ��Rn+��ʾVO2+��Fe3+��HA��ʾ�л���ȡ��)��
RAn(�л���)+nH+(ˮ��)(ʽ��Rn+��ʾVO2+��Fe3+��HA��ʾ�л���ȡ��)��
�ش���������:
��1����������������з���������ԭ��Ӧ�Ļ�ѧ����ʽΪ______________��
��2����ȡʱӦ�����������������___________________��
��3���������з�Ӧ�����ӷ���ʽΪ___________________��
��4��������25��Cʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
ͨ���������ݷ�������ʵ�������У����м��백ˮ��������Һ�����pH��ΧΪ______��
�����백ˮ������ҺpH=2���������ʴﵽ93%�Ҳ�����Fe(OH)3���������ʱ��Һ��c(Fe3+)<_____mol/L(��25����㣬25��ʱKsp[Fe(OH)3]=2.6��10-39)��
��5��V2O5�������������ǿ������Һ����VO2+��ʽ���ڣ�VO2+����ǿ�����ԣ��ܽ�I-����ΪI2����������ԭΪVO+����V2O5������ᷴӦ�����ӷ���ʽΪ_________________��
��6��Ϊ��߷��Ļ����ʣ��������������ν��У��������������ǿ���Խ���Һ����c(VO2+)=amol/L������������ÿ����һ�Σ�VO2+��ȡ��Ϊ80%��4�β�������ǿ���Խ���Һ����c(VO2+)=_______mol/L(��ȡ��=![]() )
)
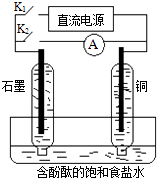
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬����ͽ��۾���ȷ����
ѡ�� | �� | �� | �������� | ���� | װ��ͼ |
A | Ũ���� | Cu | ����-KI��Һ���� | NO2Ϊ���������� |
|
B | ϡ���� | Na2SO3 | Ʒ����Һ��ɫ | Na2SO3δ���� | |
C | Ũ���� | MnO2 | FeBr2��Һ��Ϊ��ɫ | �����ԣ�Cl2��Br2 | |
D | Ũ��ˮ | NaOH | ʪ���ɫʯ����ֽ���� | NH3Ϊ�������� |
A. A B. B C. C D. D