��Ŀ����
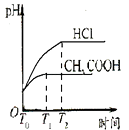
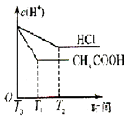
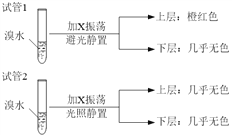
����Ŀ����������������ع���ʱ��ӦΪ��4VB2��11O2===4B2O3��2V2O5���������øõ��Ϊ��Դ���ö��Ե缫��ⱥ���Ȼ�����Һ��װ����ͼ�������·��ͨ��0.04 mol����ʱ����װ������Һ�����Ϊ400 mL��������˵����ȷ����
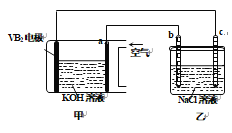
A. ���·�е�����a�缫����b�缫
B. c�缫��������������Ϊ4.48 L
C. ��װ������Һ��pHΪ13
D. VB2�缫�����ĵ缫��ӦΪ��2VB2��11H2O�D22e-===V2O5��2B2O3��22H+
���𰸡�C
��������A�����·�е�����b�缫����a�缫����A����;B��״����֪�������������B����;C�����Ե缫��ⱥ���Ȼ�����Һ�����������������������������ӷ���ʽ:2Cl-+2H2O=2OH-+H2��+Cl2���������·��ͨ��0.04mol����ʱ���������������ӵ����ʵ���Ϊ: 0.04mol������c(OH-)=0.04mol /0.4L=0.1mol/L��������Һ��pHΪ13������Cѡ������ȷ��;D����������VB2ʧ���ӷ���������Ӧ����VB2�������ĵ缫��ӦΪ: 2VB2��11H2O-22e-===V2O5��2B2O3��22H+����D����;����Cѡ������ȷ��.

��ϰ��ϵ�д�
�����Ŀ