题目内容
【题目】金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
表1 浸出液成分
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
浓度/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
(1)浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
浸出液在不同pH下萃取的结果如图1。
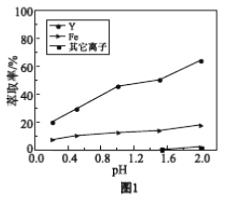
①用化学平衡原理解释,随pH增大,Y3+萃取率增大的原因________。
②结合图1解释,工业上萃取Y3+之前,应首先除去Fe3+的原因是________。
(2)采用“中和沉淀法”和“磷酸法”可以除铁。
表2 Fe3+、Y3+去除率
终点pH | 去除率/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
中和沉淀法:向浸出液中加入NaOH除Fe3+,去除率如表2所示。
①该实验条件下,Fe3+去除率比Y3+大的可能原因________。
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,再加入Na2CO3溶液,调pH为2.5,过滤除去磷酸铁沉淀(FePO4),滤液中剩余的Fe3+、Y3+浓度如表3。
表3 滤液中Fe3+、Y3+的浓度
Fe3+ | Y3+ | |
浓度/(mgL-1) | 508 | 68.9 |
② 配平“磷酸法”除铁过程中的离子方程式
Fe3+ + + = FePO4↓+ CO2↑+ ,___________________
③ 综合分析表1、表2、表3,工业上采用“磷酸法”除铁的原因________。
(3)经“磷酸法”除铁后,用有机溶剂HR萃取Y3+,可通过________(填操作)收集含Y3+的有机溶液。
(4)综合分析以上材料,下列说法合理的是________。
a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的Fe3+多于水溶液中的Fe3+
b. 表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低
【答案】 Y3+在溶液中存在平衡:Y3++3HR![]() YR3+3H+,pH增大,c(H+) 减小(或c(OH-)增大),平衡右移,Y3+萃取率提高 Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大 KSP[Fe(OH) 3]小于KSP[Y(OH) 3]或Fe(OH) 3的溶解度小于Y(OH) 3或c(Fe 3+)远大于c(Y3+) 2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O 磷酸法除铁率较高同时Y3+损失率较小 分液 bcd
YR3+3H+,pH增大,c(H+) 减小(或c(OH-)增大),平衡右移,Y3+萃取率提高 Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大 KSP[Fe(OH) 3]小于KSP[Y(OH) 3]或Fe(OH) 3的溶解度小于Y(OH) 3或c(Fe 3+)远大于c(Y3+) 2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O 磷酸法除铁率较高同时Y3+损失率较小 分液 bcd
【解析】考查化学反应原理的综合运用,(1)①Y3+的溶液中存在:Y3++3HR![]() YR3+3H+,pH增大,c(H+)减小,根据勒夏特列原理,平衡向正反应方向移动,Y3+的转化率增大,即Y3+萃取率提高;②根据Fe3+ + 3HR
YR3+3H+,pH增大,c(H+)减小,根据勒夏特列原理,平衡向正反应方向移动,Y3+的转化率增大,即Y3+萃取率提高;②根据Fe3+ + 3HR ![]() FeR3 + 3H+,Y3+ + 3HR
FeR3 + 3H+,Y3+ + 3HR ![]() YR3 + 3H+ ,Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大,因此萃取Y3+之前,应除去Fe3+,防止对Y3+萃取产生干扰;(2)①表2采用的是中和沉淀法,通过条件pH,Fe3+去除率高,其原因可能是KSO[Fe(OH)3]<Ksp[Y(OH)3],或者Fe(OH)3的溶解度远远小于Y(OH)3溶解度;②根据原理,加入的物质Fe3+、H3PO4、Na2CO3,生成了FePO4和CO2,没有化合价的变化,因此离子反应是Fe3++H3PO4+CO32-→FePO4↓+CO2↑,H3PO4中H转化成H2O,Fe3++H3PO4+CO32-→FePO4↓+CO2↑+H2O,根据电荷守恒和原子守恒进行配平,即2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O;③根据表1、2、3中的数据,得出磷酸法除铁率较高同时Y3+损失率较小;(3)有机溶剂为萃取剂,不溶于水,因此采用分液方法进行分离;(4)a、根据Fe3+ + 3HR
YR3 + 3H+ ,Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大,因此萃取Y3+之前,应除去Fe3+,防止对Y3+萃取产生干扰;(2)①表2采用的是中和沉淀法,通过条件pH,Fe3+去除率高,其原因可能是KSO[Fe(OH)3]<Ksp[Y(OH)3],或者Fe(OH)3的溶解度远远小于Y(OH)3溶解度;②根据原理,加入的物质Fe3+、H3PO4、Na2CO3,生成了FePO4和CO2,没有化合价的变化,因此离子反应是Fe3++H3PO4+CO32-→FePO4↓+CO2↑,H3PO4中H转化成H2O,Fe3++H3PO4+CO32-→FePO4↓+CO2↑+H2O,根据电荷守恒和原子守恒进行配平,即2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O;③根据表1、2、3中的数据,得出磷酸法除铁率较高同时Y3+损失率较小;(3)有机溶剂为萃取剂,不溶于水,因此采用分液方法进行分离;(4)a、根据Fe3+ + 3HR ![]() FeR3 + 3H+,pH越大,Fe3+萃取率提高,但有机溶剂中不含有Fe3+而是FeR3,pH在0.2~2.0范围内,有机溶剂中的Fe3+小于水溶液中的Fe3+ ,故a错误;b、表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附,氢氧化铁表面积大,能够吸附微粒,故b正确;c、表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓,故c正确;d、有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低,故d正确。
FeR3 + 3H+,pH越大,Fe3+萃取率提高,但有机溶剂中不含有Fe3+而是FeR3,pH在0.2~2.0范围内,有机溶剂中的Fe3+小于水溶液中的Fe3+ ,故a错误;b、表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附,氢氧化铁表面积大,能够吸附微粒,故b正确;c、表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓,故c正确;d、有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低,故d正确。

 阅读快车系列答案
阅读快车系列答案【题目】利用如图所示装置进行下列实验,现象和结论均正确的是
选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
A. A B. B C. C D. D