题目内容
【题目】根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验。已知:
①SO2+Br2+2H2O→2HBr+H2SO4;②FeS+2HCl→FeCl2+ H2S↑(FeS块状固体难溶于水)
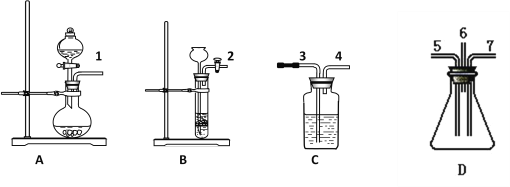
可选用的仪器如图所示:
可选用的试剂:
①稀盐酸,②溴水,③Na2SO3粉末状固体,④FeS固体,⑤品红溶液,⑥氢氧化钠溶液,⑦浓硫酸。试回答下列问题:
(1)制取SO2气体选用装置____( 从A——D中选取,填字母),选用的试剂是____和______(从①——⑦中选取,填数字)。
(2) 制取H2S气体选用装置____( 从A——D中选取,填字母),选用的试剂是____和_____(从①——⑦中选取,填数字)。
(3)表现SO2氧化性的实验是上述仪器中的D装置,有关化学方程式是______________________;
表现SO2还原性的实验是上述仪器中的_______装置,能观察到的实验现象是_______________。
(4)为了防止污染空气,从装置D出气口排出的气体要用_____吸收(从①——⑦中选取,填数字)。
【答案】 A 3 7 B 4 1 略 C 溴水褪色 6
【解析】验证SO2既有氧化性又有还原性的实验,由图可知,A中制备SO2,B中制备H2S,在C中加溴水,1与3相连,溴水褪色,发生SO2+Br2+2H2O=H2SO4+2HBr;4与5相连,同时2与7相连,二氧化硫与硫化氢均进入D中发生2H2S+SO2=3S↓+2H2O,然后出气口6与3相连,此时C中为NaOH溶液进行尾气处理,则
(1)根据以上分析可知制取SO2气体选用装置A,盐酸易挥发,选用的试剂是亚硫酸钠和浓硫酸。(2)制取H2S气体选用装置B,浓硫酸具有强氧化性,能氧化H2S,选用的试剂是盐酸和FeS。(3)S元素的化合价降低,体现二氧化硫的氧化性,观察到装置内壁上有淡黄色的固体析出和液滴生成,其反应方程式为2H2S+SO2=3S↓+2H2O;C中发生SO2+Br2+2H2O=H2SO4+2HBr,S元素的化合价升高,体现二氧化硫的还原性,观察到溴水褪色;(4)该实验中二氧化硫、硫化氢、溴蒸气均为有毒气体,严重污染大气,必须净化后再放空,则装置D的出气管应连接盛有NaOH溶液的C装置。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】化学与生产生活密切相关,下列物质的用途及解释均正确的是
选项 | 用途 | 解释 |
A | 可用FeCl3溶液刻蚀铜制电路板 | Fe3+的氧化性强于Cu2+ |
B | 碳与石英反应可冶炼粗硅 | 碳的非金属性比硅强 |
C | 四氯化碳可用于灭火 | 四氯化碳的沸点高 |
D | 酸性KMnO4溶 液可漂白织物 | KMnO4有强氧化性 |
A. A B. B C. C D. D