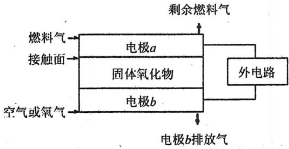
题目内容
(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
| 化合物 | 甲 | 乙 | 丙 |
| 原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶2 |
(1)元素D在元素周期中的位置 。
(2)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
(3)写出图I中沸点最高的单质与NaOH溶液反应的离子方程式 。
(8分,每空2分)⑴第三周期第VIA族;⑵C3N4、大于;⑶2Al+2OH-+2H2O=2AlO2-+3H2↑
解析

练习册系列答案
相关题目