��Ŀ����
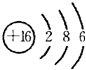
����ԭ���������������A��B��C��D��E��F��G���ֶ���������Ԫ�أ���֪Aԭ�Ӻ��������ӣ�A��B��D��Ԫ�صĺ˵����֮�ͱ�GԪ�صĺ˵������2��DԪ��ԭ�ӵ������������ȴ�����4��EԪ�ص�ԭ�Ӱ뾶�Ƕ���������Ԫ�������F2-��G-���������ӵĵ��Ӳ�ṹ���ԭ����ͬ��
��1��E2F��ˮ��Һ�� �ԣ�д����Ҫ��Ӧ�����ӷ���ʽ�� ��
��2����ҵ�ϵ��EG��ˮ��Һ�����ӻ�ѧ����ʽ�ǣ� ��
��3��1molFD2��һ����������D2��ȫ��Ӧ������̬������ų�98.3KJ������д�����Ȼ�ѧ����ʽ�� ��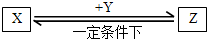
��4�����б仯�У���ͼ�������ʾ�Ϊ��������Ԫ�ؼ��γɵĵ��ʻ����ı仯��ijЩ��Ӧ������ijЩ��������ȥ���밴Ҫ��дһ����ѧ����ʽ��ش��й����⣮
����X��Y��Ϊ��̬�⻯���X��Y��Ӧ�Ļ�ѧ����ʽ�� ��
����X��Y��Ϊ���Ԫ����ͬ����ʽ�Σ���X��Y��Ӧ�Ļ�ѧ����ʽ�� ��
����X��Y�����������࣬���������Ԫ����ͬ����������Ԫ�أ�������Է�������֮��Ϊ14������������NaOH��Һ��Ӧ�����������ᷴӦ����X��Y����Է���������С�������� ��
��1��E2F��ˮ��Һ��
��2����ҵ�ϵ��EG��ˮ��Һ�����ӻ�ѧ����ʽ�ǣ�
��3��1molFD2��һ����������D2��ȫ��Ӧ������̬������ų�98.3KJ������д�����Ȼ�ѧ����ʽ��
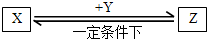
��4�����б仯�У���ͼ�������ʾ�Ϊ��������Ԫ�ؼ��γɵĵ��ʻ����ı仯��ijЩ��Ӧ������ijЩ��������ȥ���밴Ҫ��дһ����ѧ����ʽ��ش��й����⣮
����X��Y��Ϊ��̬�⻯���X��Y��Ӧ�Ļ�ѧ����ʽ��
����X��Y��Ϊ���Ԫ����ͬ����ʽ�Σ���X��Y��Ӧ�Ļ�ѧ����ʽ��
����X��Y�����������࣬���������Ԫ����ͬ����������Ԫ�أ�������Է�������֮��Ϊ14������������NaOH��Һ��Ӧ�����������ᷴӦ����X��Y����Է���������С��������
������ԭ���������������A��B��C��D��E��F��G���ֶ���������Ԫ�أ���֪Aԭ�Ӻ��������ӣ���AΪH��DԪ��ԭ�ӵ������������ȴ�����4����DΪO��F2-��G-���������ӵĵ��Ӳ�ṹ���ԭ����ͬ����F2-ΪS2-��G-ΪCl-����FΪS��GΪCl��A��B��D��Ԫ�صĺ˵����֮�ͱ�GԪ�صĺ˵������2����1+8+B=17-2������B=6����BΪC������ΪB��C��Dԭ������������������CΪN��ͬ�����м����Ԫ�ص�ԭ�Ӱ뾶�������EΪNa��
��1��Na2S��ǿ�������Σ�ˮ���Լ��ԣ����ݷ�Ӧ��Ͳ���д�����ӷ���ʽ��
��2�����NaClˮ��Һ�����������������������ƣ�
��3�������Ȼ�ѧ����ʽ����д����д�������ʵ���֮�ȵ��������������Ӧ�ȣ�
��4����X��Y��Ϊ��̬�⻯����Ҷ��߷�Ӧ����Z������X��YΪNH3��HCl��
��X��Y��Ϊ���Ԫ����ͬ����ʽ�Σ�˵����Ԫ��������������ʽ�Σ���ΪNaHSO3��NaHSO4��
����X��Y�����������࣬���������Ԫ����ͬ����������Ԫ�أ�������Է�������֮��Ϊ14������������NaOH��Һ��Ӧ�����������ᷴӦ��˵����������Ϊ�����ᣮ
��1��Na2S��ǿ�������Σ�ˮ���Լ��ԣ����ݷ�Ӧ��Ͳ���д�����ӷ���ʽ��
��2�����NaClˮ��Һ�����������������������ƣ�
��3�������Ȼ�ѧ����ʽ����д����д�������ʵ���֮�ȵ��������������Ӧ�ȣ�
��4����X��Y��Ϊ��̬�⻯����Ҷ��߷�Ӧ����Z������X��YΪNH3��HCl��
��X��Y��Ϊ���Ԫ����ͬ����ʽ�Σ�˵����Ԫ��������������ʽ�Σ���ΪNaHSO3��NaHSO4��
����X��Y�����������࣬���������Ԫ����ͬ����������Ԫ�أ�������Է�������֮��Ϊ14������������NaOH��Һ��Ӧ�����������ᷴӦ��˵����������Ϊ�����ᣮ
����⣺ԭ���������������A��B��C��D��E��F��G���ֶ���������Ԫ�أ���֪Aԭ�Ӻ��������ӣ���AΪH��DԪ��ԭ�ӵ������������ȴ�����4����DΪO��F2-��G-���������ӵĵ��Ӳ�ṹ���ԭ����ͬ����F2-ΪS2-��G-ΪCl-����FΪS��GΪCl��A��B��D��Ԫ�صĺ˵����֮�ͱ�GԪ�صĺ˵������2����1+8+B=17-2������B=6����BΪC������ΪB��C��Dԭ������������������CΪN��ͬ�����м����Ԫ�ص�ԭ�Ӱ뾶�������EΪNa��
��1��Na2S��ǿ�������Σ�ˮ���Լ��ԣ�S2-��H2O��Ӧ����HS-��OH-�������ӷ���ʽΪ��S2-+H2O=HS-+OH-���ʴ�Ϊ���S2-+H2O=HS-+OH-��
��2�����NaClˮ��Һ�����������������������ƣ����ⷽ��ʽΪ��2Cl-+2H2O
2OH-+H2��+Cl2�����ʴ�Ϊ��2Cl-+2H2O
2OH-+H2��+Cl2����
��3��1molSO2��һ����������O2��ȫ��Ӧ������̬������SO3�ų�98.3KJ������������2molSO3�ų�196.6KJ�������������Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g���T2SO3��g����H=-196.6kJ/mol���ʴ�Ϊ��2SO2��g��+O2��g���T2SO3��g������H=-196.6kJ/mol��
��4����X��Y��Ϊ��̬�⻯����Ҷ��߷�Ӧ����Z������X��YΪNH3��HCl���䷴Ӧ�Ļ�ѧ����ʽ��NH3+HCl=NH4Cl���ʴ�Ϊ��NH3+HCl=NH4Cl��
��X��Y��Ϊ���Ԫ����ͬ����ʽ�Σ�˵����Ԫ�����������ֶ�Ԫ����Ԫ�ᣬ��ΪH2SO3��H2SO4����������ʽ��ΪNaHSO3��NaHSO4�����䷴Ӧ�Ļ�ѧ����ʽΪ��NaHSO3+NaHSO4=Na2SO4+SO2��+H2O���ʴ�Ϊ��NaHSO3+NaHSO4=Na2SO4+SO2��+H2O��
����X��Y�����������࣬���������Ԫ����ͬ����������Ԫ�أ�������Է�������֮��Ϊ14������������NaOH��Һ��Ӧ�����������ᷴӦ��˵���������ʼ����������Լ��ԣ����Ը�����Ϊ�����ᣬ������Է���������С�������Ǹʰ��ᣬ�ʴ�Ϊ���ʰ��ᣮ
��1��Na2S��ǿ�������Σ�ˮ���Լ��ԣ�S2-��H2O��Ӧ����HS-��OH-�������ӷ���ʽΪ��S2-+H2O=HS-+OH-���ʴ�Ϊ���S2-+H2O=HS-+OH-��
��2�����NaClˮ��Һ�����������������������ƣ����ⷽ��ʽΪ��2Cl-+2H2O
| ||
| ||
��3��1molSO2��һ����������O2��ȫ��Ӧ������̬������SO3�ų�98.3KJ������������2molSO3�ų�196.6KJ�������������Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g���T2SO3��g����H=-196.6kJ/mol���ʴ�Ϊ��2SO2��g��+O2��g���T2SO3��g������H=-196.6kJ/mol��
��4����X��Y��Ϊ��̬�⻯����Ҷ��߷�Ӧ����Z������X��YΪNH3��HCl���䷴Ӧ�Ļ�ѧ����ʽ��NH3+HCl=NH4Cl���ʴ�Ϊ��NH3+HCl=NH4Cl��
��X��Y��Ϊ���Ԫ����ͬ����ʽ�Σ�˵����Ԫ�����������ֶ�Ԫ����Ԫ�ᣬ��ΪH2SO3��H2SO4����������ʽ��ΪNaHSO3��NaHSO4�����䷴Ӧ�Ļ�ѧ����ʽΪ��NaHSO3+NaHSO4=Na2SO4+SO2��+H2O���ʴ�Ϊ��NaHSO3+NaHSO4=Na2SO4+SO2��+H2O��
����X��Y�����������࣬���������Ԫ����ͬ����������Ԫ�أ�������Է�������֮��Ϊ14������������NaOH��Һ��Ӧ�����������ᷴӦ��˵���������ʼ����������Լ��ԣ����Ը�����Ϊ�����ᣬ������Է���������С�������Ǹʰ��ᣬ�ʴ�Ϊ���ʰ��ᣮ
���������⿼����Ԫ�ص��ƶϡ�Ԫ�ص����ʣ�����ʽ����д������֮���ת���ȣ���ȷԭ�ӵĵ��Ӳ�ṹ��Ԫ���������ǽⱾ��Ĺؼ�����Ŀ�漰��֪ʶ��϶࣬�ѶȽϴ�

��ϰ��ϵ�д�
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
�����Ŀ