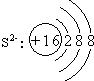题目内容
原子序数依次增大的A、B、C、D都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)D的离子结构示意图是 ,A和B形成的化合物中含有非极性共价键的是 ,该物质的电子式是 。
(2)加热时,D单质能跟B的最高价氧化物对应水化物的浓溶液发生氧化还原反应,生成两种盐,该氧化还原反应的离子方程式为 。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式 。
(1) ;Na2O2,
;Na2O2,![]() ;
;
(2)3S + 6OH- =加热= 2S2- + SO32- + 3H2O ;(3)Al(OH)3+OH-=AlO2-+2H2O。
解析:
“B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水”且B、C、D原子序数依次增大,可知C的最高价氧化物对应的水化物具有两性,即Al(OH)3,故C为Al;Al(OH)3只能和强碱反应,故B为Na;A的原子结构中最外层电子数是电子层数的3倍,A为氧;A、D同主族,D为硫。所以,A、B、C、D依次为O、Na、Al、S。

练习册系列答案
相关题目