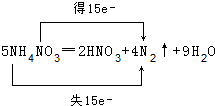
题目内容
16.用NA代表阿伏加德罗常数,下列表述正确的是( )| A. | 1L0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 1mol羟基中电子数为10 NA |
分析 A.铜离子部分水解,导致铜离子的数目减少;
B.过氧化钠中的过氧根离子含有1个共用电子对,0.1mol过氧化钠含有0.1mol共用电子对;
C.pH=13的溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子;
D.羟基中含有9个电子,1mol羟基中含有9mol电子.
解答 解:A.1L 0.5 mol•L-1CuCl2溶液中含有0.5mol氯化铜,由于铜离子部分水解,则溶液中含有的铜离子小于0.5mol,含有Cu2+的个数小于0.5NA,故A错误;
B.7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠中含有0.1mol共用电子对,含有的共用电子对数为0.1NA,故B错误;
C.25℃时,pH=13的溶液中氢氧根离子浓度为0.1mol/L,1.0L该Ba(OH)2溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故C正确;
D.羟基为中性原子团,1mol羟基中含有9mol电子,含有的电子数为9NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,D为易错点,注意羟基与氢氧根离子的区别.

练习册系列答案
相关题目
6.在刚性密闭容器中加入P、Q发生下列反应,P(g)+2Q(g)?2S(g)+R(s)下列说法可以说明反应已达平衡的是( )
| A. | 反应容器中压强不随时间变化而变化 | |
| B. | 反应容器中P、Q、R、S四者共存 | |
| C. | P和R的生成速率相等 | |
| D. | 反应容器中物质的总物质的量保持不变 |
7.下列说法正确的是( )
| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | BaSO4是弱电解质 | |
| C. | 蔗糖、CO2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
4.下列说法错误的是( )
| A. | 由单质A转化为单质B,△H=+119kJ/mol,可知单质A比单质B稳定 | |
| B. | 灼热的碳与CO2反应既是氧化还原反应,又是吸热反应 | |
| C. | 决定化学反应速率的根本因素是参加反应的各物质的结构和性质 | |
| D. | 对于一个可逆反应(△H<0)达到平衡后,升高温度可以使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
11.由CH4和O2组成的混合气体,标准状况下的密度为1g•L-1,则该混合气体中CH4和O2的质量比为( )
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
1.下列关于摩尔质量的说法正确的是( )
| A. | HNO3的摩尔质量是63g | |
| B. | 物质的摩尔质量越大,物质的质量越大 | |
| C. | 摩尔质量就等于该物质的相对分子质量 | |
| D. | 醋酸的摩尔质量在数值上与NA个醋酸分子的质量相等 |
8.在一定条件下的密闭容器中发生反应:N2O4(g)?2NO2(g),经1min后反应达到平衡,c(N2O4)从0.100mol•L-1降为0.040mol•L-1,下列有关说法中,不正确的是( )
| A. | 1min内的平均反应速率v(N2O4)为0.060mol•L-1•min-1 | |
| B. | 若容器的体积为1L,则反应经0.5min后容器内n(NO2)为0.060mol | |
| C. | 反应达到平衡前,2v(N2O4)=v(NO2) | |
| D. | 反应达到平衡时,2v(N2O4)=v(NO2) |
10.将一小块金属钠投入下列物质的溶液中,既能放出气体,又有沉淀析出的是( )
| A. | NH4Cl | B. | BaCl2 | C. | CuCl2 | D. | NaHCO3 |