题目内容
1.下列化合物沸点比较错误的是( )| A. | 丁烷>乙烷>甲烷 | B. | 1-氯戊烷<1-氯丙烷 | ||
| C. | 一氯乙烷>一氟乙烷 | D. | 正戊烷>异戊烷>新戊烷 |
分析 烷烃、卤代烃都是分子晶体,其熔沸点与相对分子质量成正比,与碳原子个数成正比,碳原子个数相同的烷烃,其支链越少熔沸点越高,据此分析解答.
解答 解:A.烷烃都是分子晶体,其熔沸点与相对分子质量成正比,与碳原子个数成正比,所以熔沸点丁烷>乙烷>甲烷,故A正确;
B.卤代烃都是分子晶体,其熔沸点与相对分子质量成正比,与碳原子个数成正比,所以熔沸点1-氯戊烷>1-氯丙烷,故B错误;
C.卤代烃都是分子晶体,其熔沸点与相对分子质量成正比,与碳原子个数成正比,所以熔沸点一氯乙烷>一氟乙烷,故C正确;
D.烷烃都是分子晶体,其熔沸点与相对分子质量成正比,与碳原子个数成正比,碳原子个数相同的烷烃,其支链越少熔沸点越高,所以熔沸点正戊烷>异戊烷>新戊烷,故D正确;
故选B.
点评 本题考查烷烃、卤代烃熔沸点高低判断,明确熔沸点高低与相对分子质量、碳原子个数、支链关系即可解答,题目难度不大.

练习册系列答案
相关题目
9. 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
12.水煤气法制甲醇工艺流程框图如下:
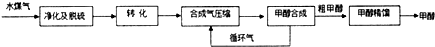
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+O2 (g)?CO(g)+2H2O (g)△H=-519KJ•mol-1.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ•mol-1.T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•(L•min)-1.
(3)生产过程中,合成气要进行循环,其目的是提高原料CO、H2的利用率(或提高产量、产率亦可);.
(4)下图1为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.

E为该燃料电池的负极极(填“正”或“负”).F电极上的电极反应式为ClO-+2e-+H2O═Cl-+2OH-.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①在N电极上乙二酸生成乙醛酸的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
②若有2molH+通过质子交换膜完全参与反应,则生成的乙醛酸为2mol.

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+O2 (g)?CO(g)+2H2O (g)△H=-519KJ•mol-1.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ•mol-1.T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•(L•min)-1.
(3)生产过程中,合成气要进行循环,其目的是提高原料CO、H2的利用率(或提高产量、产率亦可);.
(4)下图1为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.

E为该燃料电池的负极极(填“正”或“负”).F电极上的电极反应式为ClO-+2e-+H2O═Cl-+2OH-.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①在N电极上乙二酸生成乙醛酸的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
②若有2molH+通过质子交换膜完全参与反应,则生成的乙醛酸为2mol.
6.钾和钠两种元素相比较,正确的是( )
| A. | 钾的还原性比钠的弱 | B. | 钾原子的半径比钠的小 | ||
| C. | 钾的金属性比钠的强 | D. | 钾单质的熔点比钠的高 |
13.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)?N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A. | 加催化剂 | B. | 增大压强 | C. | 充入N2 | D. | 降低温度 |
10.石墨和金刚石在一定条件下可以相互转化,这一变化属于( )
| A. | 物理变化 | B. | 化学变化 | C. | 化合反应 | D. | 分解反应 |
11.2008年世界环境日,中国提出的主题为“绿色奥运与环境友好型社会”.爱护环境,呵护地球是我们每一个人不可推卸的责任.下列大气污染现象与污染源对应不正确的是( )
| A. | 酸雨--硫的氧化物、氮的氧化物 | |
| B. | 光化学烟雾--碳氢化合物、氮的氧化物 | |
| C. | 臭氧空洞--氟氯烃(即氟利昂) | |
| D. | 温室效应--SO2 |