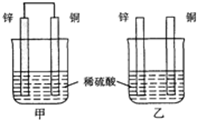
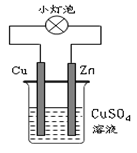
题目内容
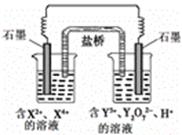
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①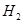 ②
②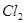 ③
③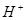 ④
④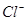 ⑤
⑤ ⑥
⑥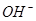
⑵写出在电解过程中阳极发生的电极方程式: 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
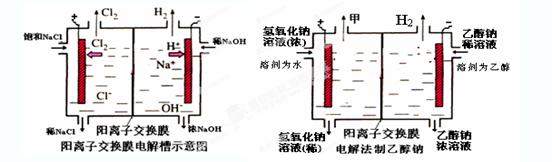
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,
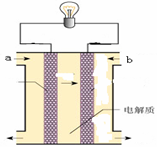
①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:
⑴这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①
 ②
②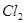 ③
③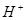 ④
④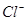 ⑤
⑤ ⑥
⑥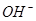
⑵写出在电解过程中阳极发生的电极方程式: 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。

⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,

①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:
(1)③⑤; (2)阳极:2Cl─-2e-=Cl2; (3)35.7%;
(4)①阳极:4OH-+4e-=2H2O+O2↑;②蒸发结晶
(5) ①H2+2OH--2e-=2H2O ;②CH4+10OH-+8e-=CO32-+7H2O
(4)①阳极:4OH-+4e-=2H2O+O2↑;②蒸发结晶
(5) ①H2+2OH--2e-=2H2O ;②CH4+10OH-+8e-=CO32-+7H2O
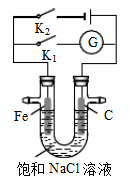
试题分析:⑴这种阳离子交换膜,只允许溶液中的阳离子H+、Na+通过,所以选项是③⑤; ⑵写出在电解过程中阳极上阴离子放电。由于放电能力Cl->OH-,所以在阳极上发生的电极方程式:2Cl─-2e-=Cl2;(3)n(H2)=896L÷22.4L/mol=40mol.及氢气的质量是80g,所以根据电解的方程式:2NaCl+2H2O
 Cl2↑+H2↑+2NaOH可知会产生80mol的NaOH,其质量是80mol×40g/mol=3200g。溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×(896L÷22.4L/mol)× 23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,所以电解后流出的氢氧化钠溶液的质量分数为(4200g÷11760g)×100%35.7%;(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+ 2e-=2CH3CH2O-+H2↑在电解过程中阳极上OH-失去电子被氧化为氧气,发生的电极方程式是4OH-+ 4e-=2H2O+O2↑;②因为乙醇钠是盐,沸点较高,而乙醇是有分子构成的物质,沸点较低,所以最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:蒸发结晶。(5)在燃料电池中通入燃料的电极是负极,发生氧化反应,通入空气或氧气的电极为正极,在正极上发生还原反应。①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式是H2+2OH--2e-=2H2O ;②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:CH4+10OH-+8e-=CO32-+7H2O
Cl2↑+H2↑+2NaOH可知会产生80mol的NaOH,其质量是80mol×40g/mol=3200g。溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×(896L÷22.4L/mol)× 23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,所以电解后流出的氢氧化钠溶液的质量分数为(4200g÷11760g)×100%35.7%;(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+ 2e-=2CH3CH2O-+H2↑在电解过程中阳极上OH-失去电子被氧化为氧气,发生的电极方程式是4OH-+ 4e-=2H2O+O2↑;②因为乙醇钠是盐,沸点较高,而乙醇是有分子构成的物质,沸点较低,所以最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:蒸发结晶。(5)在燃料电池中通入燃料的电极是负极,发生氧化反应,通入空气或氧气的电极为正极,在正极上发生还原反应。①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式是H2+2OH--2e-=2H2O ;②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:CH4+10OH-+8e-=CO32-+7H2O
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目