题目内容
【题目】某小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验 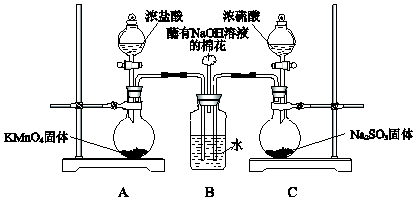
(1)装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中氧化剂和还原剂的物质的量之比是 , 生成71g Cl2时反应转移的电子是mol,装置C中生成SO2 , 反应的化学方程式是
(2)装置B中蘸有NaOH溶液的棉花的作用是
(3)SO2与Cl2同时通入水中反应的化学方程式是 .
【答案】
(1)1:5;2;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
(2)尾气处理,防止污染空气
(3)SO2+Cl2+2H2O═2HCl+H2SO4
【解析】解:(1)元素化合价升高的失电子做还原剂,元素化合价降低的做氧化剂,装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是KMnO4 , 反应中氧化剂和还原剂的物质的量之比是1:5,生成氯气5mol×71g/mol=355g,电子转移10mol,则生成71g Cl2转移的电子是2mol,装置C中浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,所以答案是:1:5;2;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;(2)氯气有毒污染空气,不能排放需要用氢氧化钠吸收剩余氯气,装置B中蘸有NaOH溶液的棉花的作用是吸收氯气尾气处理,防止污染空气,
所以答案是:尾气处理,防止污染空气;(3)二氧化硫和氯气同时通入水中发生氧化还原反应生成了盐酸和硫酸,化学方程式为:SO2+Cl2+2H2O═2HCl+H2SO4 , 所以答案是:SO2+Cl2+2H2O═2HCl+H2SO4 .