题目内容
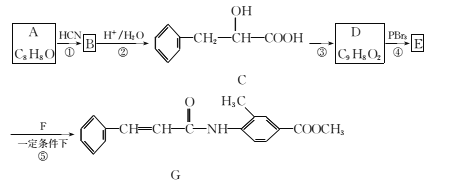
【题目】电—Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应,Fe2++H2O2=Fe3++OH-+OH,生成的烃基自由基(OH)能氧化降解有机污染物。下列说法正确的是( )
A. 电解池左边电极的电势比右边电极的电势高
B. 电解池中只有O2和Fe3+发生还原反应
C. 消耗1 molO2,电解池右边电极产生4mol OH
D. 电解池工作时,右边电极附近溶液的pH增大
【答案】C
【解析】
A. 电解池左边电极上Fe2+失电子产生Fe3+,作为阳极,电势比右边电极的电势低,选项A错误;
B. O2、Fe3+在阴极上得电子发生还原反应,H2O2与Fe2+反应,则H2O2发生得电子的还原反应,选项B错误;
C. 1 molO2转化为2 mol H2O2转移2 mole-,由Fe2++H2O2=Fe3++OH-+OH可知,生成2mol OH,阳极电极方程式为H2O-e-=OH+H+,转移2 mole-,在阳极上生成2mol OH,因此消耗1 molO2,电解池右边电极产生4mol OH,选项C正确;
D. 电解池工作时,右边电极水失电子生成羟基和氢离子,其电极方程式为H2O-e-=OH+H+,附近溶液的pH减小,选项D错误;
答案选C。

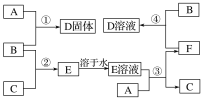
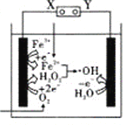
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据上右表数据,请你判断该电池工作的适宜应控制在_________(填字母)范围内。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100~300℃ c.300~350℃ d.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。
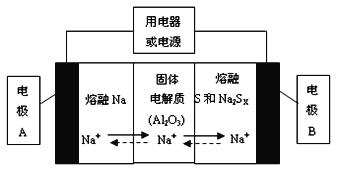
(2)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:___________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________。
(3)若把钠硫电池作为电源,按如图所示装置进行实验电解乙池和丙池:
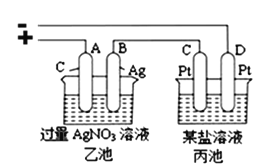
当钠硫电池中消耗0.05xmol的S时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“C”或“D”)电极析出7.20g金属,则丙装置中的某盐溶液可能是_______(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
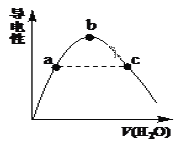
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。