题目内容
19.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )| A. | 食盐和蔗糖熔化 | B. | 乙醇和氯化氢溶于水 | ||
| C. | 碘和干冰升华 | D. | 二氧化硅和氧化钠熔化 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A.食盐是离子晶体,蔗糖是分子晶体,克服作用力分别为离子键、分子间作用力,故A错误;
B.乙醇为非电解质,氯化氢为电解质,氯化氢溶于水破坏共价键,而乙醇溶于水破坏分子间作用力,故B错误;
C.碘、干冰都是分子晶体,升华均克服分子间作用力,故C正确;
D.二氧化硅为原子晶体,氧化钠为离子晶体,熔化所克服的粒子间的相互作用分别为共价键、离子键,故D错误.
故选C.
点评 本题考查晶体类型与化学键,注意此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
9.下列说法正确的是( )
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能增加单位体积内活化分子的百分数和活化分子总数使反应速率增大 | |
| D. | 缩小容器的体积而增大压强,可增加活化分子总数,从而使反应速率增大 |
10.A、B、C、D、E是短周期主族元素,其原子序数依次增大.A元素的气态氢化物可以与A元素的最高价氧化物对应的水化物反应生成盐,B元素原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,B和E处于同一族,B、E元素原子的核外电子数之和与C、D元素原子的核外电子数之和相等.下列说法不正确的是( )
| A. | B、C、D、E四种元素原子半径由大到小的顺序是:C>E>D>B | |
| B. | C和D两元素的最高价氧化物对应水化物的碱性:C>D | |
| C. | B和E两元素的气态氢化物热稳定性:B>E | |
| D. | A元素的气态氢化物与其最高价氧化物对应的水化物反应后产物中既含有离子键又含有共价键 |
7.下述情况下物质的量可能不相等的是( )
| A. | 密度相等,等体积的NO和 C2H6 (g) | B. | 常温常压下,等体积的NO和 C2H6 (g) | ||
| C. | 等温条件下,等体积的NO和 C2H6 (g) | D. | 常温常压下,等质量的NO和 C2H6 (g) |
4.下列关于NH4Cl的说法中不正确的是( )
| A. | 氨气遇到HCl时,可以迅速反应生成NH4Cl | |
| B. | 0.5molNH4Cl中含有氢原子的质量是2克 | |
| C. | NH4Cl易溶于水,很稳定,受热不会分解 | |
| D. | 加热NH4Cl和碱的混合物,可以制取到氨气 |
3.下列表述正确的是( )
| A. | 2-丁烯的结构式CH3CH=CHCH3 | B. | 聚丙烯的结构简式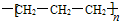 | ||
| C. | 四氯化碳分子的电子式 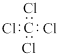 | D. | 丙烷分子的球棍模型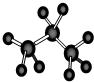 |
20.下列物质中既有离子键又有共价键的可溶性化合物是( )
| A. | H2SO4 | B. | BaSO4 | C. | N2 | D. | NaOH |
1.下列各组表述中,两个微粒一定属于同种元素原子的是( )
| A. | 3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子 | |
| B. | 2p能级有一个未成对电子的基态原子和价电子排布为 2s22p5的原子 | |
| C. | M层全充满而N层为4s2的原子和核外电子排布为 1s22s22p63s23p63d64s2的原子 | |
| D. | 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子 |
 熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题:
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题: