��Ŀ����
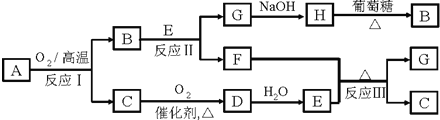
������A�����ֳ���Ԫ����ɣ���A������Ԫ�ص�������Ϊ4��1��A����ͼ��ʾת����ϵ������B��F��Ϊ��ɫ���壬C��ʹƷ����Һ��ɫ���еķ�Ӧ������ˮ��Һ�н��У��еķ�Ӧ��������δȫ����������
��1��д���������ʵĻ�ѧʽ��A
��2����ӦI�л�ԭ���������������ʵ���֮��Ϊ
��Ӧ������ӷ���ʽΪ
��Ӧ��Ļ�ѧ����ʽΪ
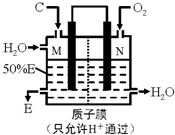
��3��ij����������ͼ��ʾװ���õ绯ѧԭ������E��N�缫��
��4����ͼ�е�C��O2������̿����ʱ��Ҳ�ܷ������ȷ�Ӧ����D��Ϊ�о��˷�Ӧ����C��O2�������Ϊ1L�ĺ����ܱ������У���
500��ʱ������Ӧ����Ӧ��Ũ��ʱ��ı仯���±���ʾ��
�ٷ�Ӧ����ʼ��2min�ڵ�ƽ����Ӧ����v��C��=
�ڵ�6minʱ�����������ٳ���0.002molO2��ͬʱ����Ӧ��ϵ���¶ȸı�ΪT����Ӧ��10minʱ���´ﵽƽ�⣬��ʱ���c��C��=
0.004mol/L�����¶�T

��1��д���������ʵĻ�ѧʽ��A
Cu2S
Cu2S
��BCu2O
Cu2O
��HCu��OH��2
Cu��OH��2
����2����ӦI�л�ԭ���������������ʵ���֮��Ϊ
2��3
2��3
����Ӧ������ӷ���ʽΪ
Cu2O+2H+=Cu+Cu2++H2O
Cu2O+2H+=Cu+Cu2++H2O
����Ӧ��Ļ�ѧ����ʽΪ
Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O
| ||
Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O
��
| ||
��3��ij����������ͼ��ʾװ���õ绯ѧԭ������E��N�缫��
��
��
����д��M�缫�ĵ缫��Ӧʽ��SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
��
��4����ͼ�е�C��O2������̿����ʱ��Ҳ�ܷ������ȷ�Ӧ����D��Ϊ�о��˷�Ӧ����C��O2�������Ϊ1L�ĺ����ܱ������У���
500��ʱ������Ӧ����Ӧ��Ũ��ʱ��ı仯���±���ʾ��
t��min�� Ũ�ȣ�mol/L�� |
0 | 1 | 2 | 3 | 4 | 5 | 6 |
| c��C�� | 0.054 | 0.034 | 0.018 | 0.012 | 0.008 | 0.006 | 0.006 |
| c��O2�� | 0.032 | 0.022 | 0.014 | 0.011 | 0.009 | 0.008 | 0.008 |
0.018mol/��L?min��
0.018mol/��L?min��
��500��ʱ���˷�Ӧ��ѧƽ�ⳣ��K��ֵΪ8000
8000
���ڵ�6minʱ�����������ٳ���0.002molO2��ͬʱ����Ӧ��ϵ���¶ȸı�ΪT����Ӧ��10minʱ���´ﵽƽ�⣬��ʱ���c��C��=
0.004mol/L�����¶�T
��
��
�������������500�森��������1��H�������Ƿ�Ӧ����BΪ��ɫ���壬��HΪCu��OH��2��BΪCu2O�������������·�Ӧ��Cu2O+2H+=Cu+Cu2++H2O����EΪ�ᣬFΪCu����C��D��E�ȷ�Ӧ��֪��CΪSO2��DΪSO3��EΪH2SO4����GΪCuSO4��AӦ����Cu��S����Ԫ�أ�������Ϊ4��1��ӦΪCu2S��
��2���������ʵ�������д�йط�Ӧ�����ӷ���ʽ���ж��������ͻ�ԭ��֮��Ĺ�ϵ��
��3��ͨ��������һ��Ϊԭ��ص�������������ԭ��Ӧ����������������Ӧ��
��4���ٸ���Ũ�ȵı仯���㷴Ӧ���ʣ�����ƽ�ⳣ������������Ũ����֮�����Է�Ӧ��Ũ����֮�����㣻
�ڼ�������¶�ʱ��ƽ�ⳣ���������¶ȶ�ƽ���ƶ���Ӱ���жϣ�
��2���������ʵ�������д�йط�Ӧ�����ӷ���ʽ���ж��������ͻ�ԭ��֮��Ĺ�ϵ��
��3��ͨ��������һ��Ϊԭ��ص�������������ԭ��Ӧ����������������Ӧ��
��4���ٸ���Ũ�ȵı仯���㷴Ӧ���ʣ�����ƽ�ⳣ������������Ũ����֮�����Է�Ӧ��Ũ����֮�����㣻
�ڼ�������¶�ʱ��ƽ�ⳣ���������¶ȶ�ƽ���ƶ���Ӱ���жϣ�
����⣺��1��H�������Ƿ�Ӧ����BΪ��ɫ���壬��HΪCu��OH��2��BΪCu2O�������������·�Ӧ��Cu2O+2H+=Cu+Cu2++H2O����EΪ�ᣬFΪCu����C��D��E�ȷ�Ӧ��֪��CΪSO2��DΪSO3��EΪH2SO4����GΪCuSO4��AӦ����Cu��S����Ԫ�أ�������Ϊ4��1��ӦΪCu2S���ʴ�Ϊ��Cu2S��Cu2O��Cu��OH��2��
��2����Ӧ��Ϊ��2Cu2S+3O2
2Cu2O+2SO2���ɷ���ʽ���Կ�������ԭ���������������ʵ���֮��Ϊ2��3��Cu2O�����������·�Ӧ��Cu2O+2H+=Cu+Cu2++H2O��Cu��Ũ�����ڼ��������·�Ӧ����CuSO4��SO2����Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��
�ʴ�Ϊ��2��3��Cu2O+2H+=Cu+Cu2++H2O��Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��
��3���������������ԣ�ӦΪԭ��ص�������������ԭ��Ӧ������������л�ԭ�ԣ�ӦΪԭ��صĸ���������������Ӧ���缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ������SO2+2H2O-2e-=SO42-+4H+��
��4����c��SO2��=
=0.018mol/��L?min����
2SO2+O2 2SO3
2SO3
��ʼ��0.054mol/L 0.032mol/L
ת����0.048mol/L 0.024mol/L 0.048mol/L
ƽ�⣺0.006moL/L 0.008mol/L 0.048mol/L
k=
=8000��
�ʴ�Ϊ��0.018mol/��L?min����8000��
�ڵ�6minʱ�����������ٳ���0.002molO2����Ӧ��10minʱ���´ﵽƽ�⣬��ʱ���c��SO2��=0.004mol/L����Ч��
2SO2+O2 2SO3
2SO3
��ʼ��0.054mol/L 0.034mol/L 0
ת����0.050mol/L 0.025mol/L 0.050mol/L
ƽ�⣺0.004moL/L 0.009mol/L 0.050mol/L
��ʱk=
=17361��8000��˵��ƽ��������Ӧ�����ƶ������÷�Ӧ���ȣ���Ӧ�ǽ����¶ȣ���С��500�棬
�ʴ�Ϊ������
��2����Ӧ��Ϊ��2Cu2S+3O2
| ||
| ||
�ʴ�Ϊ��2��3��Cu2O+2H+=Cu+Cu2++H2O��Cu+2H2SO4��Ũ��
| ||
��3���������������ԣ�ӦΪԭ��ص�������������ԭ��Ӧ������������л�ԭ�ԣ�ӦΪԭ��صĸ���������������Ӧ���缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ������SO2+2H2O-2e-=SO42-+4H+��
��4����c��SO2��=
| 0.054moL/L-0.018mol/L |
| 2min |
2SO2+O2
 2SO3
2SO3��ʼ��0.054mol/L 0.032mol/L
ת����0.048mol/L 0.024mol/L 0.048mol/L
ƽ�⣺0.006moL/L 0.008mol/L 0.048mol/L
k=
| 0.0482 |
| 0.0062��0.008 |
�ʴ�Ϊ��0.018mol/��L?min����8000��
�ڵ�6minʱ�����������ٳ���0.002molO2����Ӧ��10minʱ���´ﵽƽ�⣬��ʱ���c��SO2��=0.004mol/L����Ч��
2SO2+O2
 2SO3
2SO3��ʼ��0.054mol/L 0.034mol/L 0
ת����0.050mol/L 0.025mol/L 0.050mol/L
ƽ�⣺0.004moL/L 0.009mol/L 0.050mol/L
��ʱk=
| 0.0502 |
| 0.004 2��0.009 |
�ʴ�Ϊ������
���������⿼��������ƶϣ���Ŀ�ۺ϶Ƚϴ��ѶȽϴ��״���Ϊ��4����ע���ƽ�ⳣ���ĽǶ��ж�ƽ���ƶ��ķ���

��ϰ��ϵ�д�
�����Ŀ
 ������(��)��������(��)��D���������ǽ������ϣ�����������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4��������֮��Ϊ3��2.
������(��)��������(��)��D���������ǽ������ϣ�����������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4��������֮��Ϊ3��2.
 ������(��)��������(��)���Ļ�ѧ����ʽ________________________________��
������(��)��������(��)���Ļ�ѧ����ʽ________________________________�� ������(��)��������(��)��D���������ǽ������ϣ�����������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4��������֮��Ϊ3��2.
������(��)��������(��)��D���������ǽ������ϣ�����������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4��������֮��Ϊ3��2.
 ������(��)��������(��)���Ļ�ѧ����ʽ________________________________��
������(��)��������(��)���Ļ�ѧ����ʽ________________________________�� ������(��)��������(��)��D���������ǽ������ϣ�����������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4��������֮��Ϊ3��2
������(��)��������(��)��D���������ǽ������ϣ�����������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4��������֮��Ϊ3��2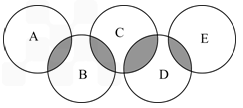
 ������(��)��������(��)���Ļ�ѧ����ʽ______________________________________��
������(��)��������(��)���Ļ�ѧ����ʽ______________________________________��