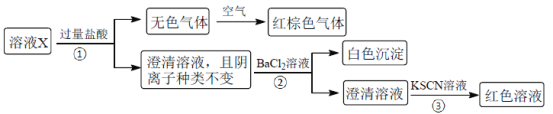
题目内容
【题目】已知同周期的![]() 、
、![]() 、
、![]() 三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为
三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.三种元素的原子序数按![]() 、
、![]() 、
、![]() 的顺序增大
的顺序增大
B.单质的氧化性按![]() 、
、![]() 、
、![]() 的顺序减弱
的顺序减弱
C.原子半径按![]() 、
、![]() 、
、![]() 的顺序增大
的顺序增大
D.气态氢化物的稳定性按![]() 、
、![]() 、
、![]() 的顺序增强
的顺序增强
【答案】D
【解析】
由三种元素最高价氧化物的水化物的化学式可知,X、Y、Z的最高化合价分别为+5、+6、+7,它们分别处在同一周期的ⅤA族、ⅥA族、ⅦA族,故三种元素的原子序数:X<Y<Z,据此分析。
由三种元素最高价氧化物的水化物的化学式可知,X、Y、Z的最高化合价分别为+5、+6、+7,它们分别处在同一周期的ⅤA族、ⅥA族、ⅦA族,故三种元素的原子序数:X<Y<Z;
A.由分析可知,原子序数:X<Y<Z,故A错误;
B.同周期主族元素单质氧化性逐渐增强,故单质的氧化性:X<Y<Z,故B错误;
C.同周期主族元素从左往右原子半径逐渐减小,故原子半径:X>Y>Z,故C错误;
D.元素非金属性越强,气态氢化物的稳定性越强,故气态氢化物的稳定性:X<Y<Z,故D正确;
故答案选D。

 名校课堂系列答案
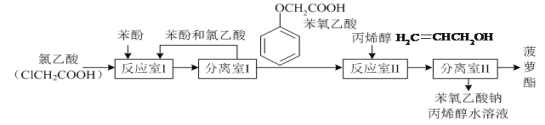
名校课堂系列答案【题目】实验室模拟工业生产食品香精菠萝酯(![]() )的简易流程如图:
)的简易流程如图:
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用________(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热.
(2)分离室I采取的操作名称是__________。
(3)苯氧乙酸含氧官能团的名称__________。
(4)下列叙述错误的是_________。
A.反应室I产物中残留的苯酚可用FeCl3溶液检验
B.反应室Ⅱ产物中残留的丙烯醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
(5)反应室I中发生反应的化学方程式是______。
(6)分离室Ⅱ的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是_______(用化学方程式表示)。