题目内容
【题目】在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置确认该混合气体中是否含有SO2和C2H4。请回答下列问题:
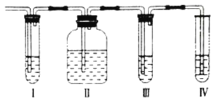
⑴上述Ⅰ、Ⅳ装置可盛放的试剂是:Ⅰ____;Ⅳ___;(请将下列有关试剂的序号填入对应装置内,可重复选用)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
⑵能说明SO2气体存在的现象是________
⑶使用装置Ⅱ的目的是_______;有关反应的离子方程式是_____。
⑷确定含有乙烯的现象是_______。
⑸为了制备重要的有机原料氯乙烷(CH3CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备;
乙同学:选乙烯和适量HCl在一定条件下制备。
你认为上述两位同学的方案中,合理的是______的方案。
【答案】A D Ⅰ中品红溶液褪色 除去二氧化硫 SO2+2OH-=SO32-+H2O Ⅲ中品红溶液不褪色,Ⅳ中酸性KMnO4溶液褪色 乙同学
【解析】
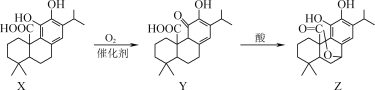
实验室用电石与饱和食盐水制备乙烯,乙烯具有碳碳双键,能与溴水发生加成反应,与酸性高锰酸钾发生氧化反应;副产物二氧化硫具有还原性和漂白性,能使品红溶液褪色,能与酸性高锰酸钾反应使其褪色。
⑴根据产物性质,首先应检验二氧化硫存在,并彻底吸收后,检验乙烯存在。Ⅰ装置可盛放品红溶液,Ⅱ装置可盛放氢氧化钠,Ⅲ装置可盛放品红溶液,检验是否除尽二氧化硫,Ⅳ装置可盛放酸性高锰酸钾,最终检验乙烯的存在。
⑵二氧化硫具有漂白性,能说明SO2气体存在的现象是Ⅰ中品红溶液褪色;
⑶装置Ⅱ中为氢氧化钠,目的是除去二氧化硫;有关反应的离子方程式是SO2+2OH-=SO32-+H2O。
⑷确定含有乙烯要保证二氧化硫全部除尽,即现象是Ⅲ中品红溶液不褪色,Ⅳ中酸性KMnO4溶液褪色。
⑸制备氯乙烷(CH3CH2Cl),甲同学:选乙烷和适量氯气在光照条件下制备,产物多样,难以控制反应产物为一氯代物;乙同学:选乙烯和适量HCl在一定条件下制备,发生加成反应,产物唯一,产率高。上述两位同学的方案中,合理的是乙同学的方案。