��Ŀ����
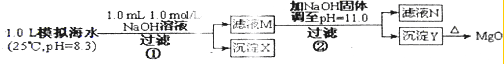
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�Mg0��ʵ�鷽����������
Kap(CaCO2)=4.96��10-3��Kap(MgCO2)=6.82��10-5��Kap[Ca(OH)2]=4.68��10-4��ע����Һ��ij���ӵ�Ũ��С��1.0��10-5mo1/L������Ϊ�����Ӳ����ڣ�ʵ������У�������Һ������䣮
��֪��Kap[Mg(OH)4]=5.61��10-12
����˵����ȷ���ǣ�������

| ģ�⺣ˮ�е�����Ũ�ȣ�mol/L�� | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
��֪��Kap[Mg(OH)4]=5.61��10-12
����˵����ȷ���ǣ�������
| A��������xΪCaCO3 |
| B����ҺM�д���Mg2+��������Ca2+ |
| C����ҺN�д���Mg2+��Ca2+ |
| D�������������Ϊ����4.2gNaOH���壬������YΪCa��OH��2��Mg��OH��2�Ļ���� |
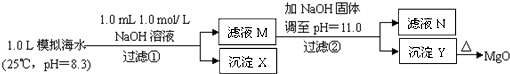
A������٣����������������֪n��NaOH ��=0.001mol��[��n��OH-��=0.001mol]���������ӷ�Ӧ�����к͡�����������������ķ�Ӧ���ɣ���1Lģ�⺣ˮ�У�����0.001mol NaOHʱ��OH- ǡ����HCO3-��ȫ��Ӧ��OH-+HCO3-=CO32-+H2O������0.001molCO32-������Ksp��CaCO3������Ksp��MgCO3�������ɵ�CO32-��ˮ�е�Ca2+��Ӧ����CaCO3 ����Ca2++CO32-=CaCO3�������Գ�����XΪCaCO3����A��ȷ��
B������CO32-ֻ��0.001mol����Ӧ����CaCO3 �����ĵ�Ca2+Ҳֻ��0.001mol����Һ�л�ʣ��c��Ca2+��=0.010 mol?L-1����ҺM��ͬʱ������Ca2+��Mg2+����B����
C������ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol?L-1����
Q[Ca��OH��2]=c��Ca2+������10-3��2=0.010����10-3��2=10-8��Ksp[Ca��OH��2]����Ca��OH��2���ɣ�
Q[Mg��OH��2]=c��Mg2+������10-3��2=0.050����10-3��2=5��10-8��Ksp[Mg��OH��2]����Mg��OH��2�������ɣ�
������Ksp[Mg��OH��2]=c��Mg2+������10-3��2=5.6��10-12��c��Mg2+��=5.6��10-6��10-5����ʣ�࣬��ҺN�в�����Mg2+����C����
D�������������Ϊ����4.2 g NaOH���壬��n��NaOH��=0.105mol����0.05mol Mg2+��Ӧ��Mg2++2OH-=Mg��OH��2��������0.05 mol Mg��OH��2��ʣ��0.005 mol OH-��
����Q[Ca��OH��2]=c��Ca2+������OH-��2=0.010����0.005��2=2.5��10-7��Ksp[Ca��OH��2]��������Ca��OH��2����������������YΪMg��OH��2��������D����
��ѡA��
B������CO32-ֻ��0.001mol����Ӧ����CaCO3 �����ĵ�Ca2+Ҳֻ��0.001mol����Һ�л�ʣ��c��Ca2+��=0.010 mol?L-1����ҺM��ͬʱ������Ca2+��Mg2+����B����
C������ڣ�����ҺM�м���NaOH ���壬����pH=11����pOH=3��ʱ����ʱ��Һ��c��OH-��=1��10-3 mol?L-1����
Q[Ca��OH��2]=c��Ca2+������10-3��2=0.010����10-3��2=10-8��Ksp[Ca��OH��2]����Ca��OH��2���ɣ�
Q[Mg��OH��2]=c��Mg2+������10-3��2=0.050����10-3��2=5��10-8��Ksp[Mg��OH��2]����Mg��OH��2�������ɣ�
������Ksp[Mg��OH��2]=c��Mg2+������10-3��2=5.6��10-12��c��Mg2+��=5.6��10-6��10-5����ʣ�࣬��ҺN�в�����Mg2+����C����
D�������������Ϊ����4.2 g NaOH���壬��n��NaOH��=0.105mol����0.05mol Mg2+��Ӧ��Mg2++2OH-=Mg��OH��2��������0.05 mol Mg��OH��2��ʣ��0.005 mol OH-��
����Q[Ca��OH��2]=c��Ca2+������OH-��2=0.010����0.005��2=2.5��10-7��Ksp[Ca��OH��2]��������Ca��OH��2����������������YΪMg��OH��2��������D����
��ѡA��

��ϰ��ϵ�д�
�����Ŀ
��2011?�㽭����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
|
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�Mg0��ʵ�鷽����������
��֪��Kap[Mg(OH)4]=5.61��10-12 ����˵����ȷ���ǣ������� |
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
 |


