题目内容
13.根据下列事实:①A+B2+═A2++B;②E+2H2O═E(OH)2↓+H2↑;③以B、D为电极与D的盐溶液组成原电池,电极反应为:D2++2e-═D,B-2e-═B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )| A. | D2+>B2+>A2+>E2+ | B. | B2+>A2+>D2+>E2+ | C. | D2+>E2+>A2+>B2+ | D. | E2+>B2+>A2+>D2+ |
分析 同一化学反应中,氧化剂的氧化性>氧化产物的氧化性.
解答 解:同一化学反应中,氧化剂的氧化性>氧化产物的氧化性.
①A+B2+=A2++B,该反应中氧化剂是B2+,氧化产物是A2+,所以B2+的氧化性>A2+的氧化性;
②E+2H2O═E(OH)2↓+H2↑,该反应中氧化剂是H2O,氧化产物是E(OH)2,所以H2O的氧化性>E2+的氧化性;
③以B、D为电极与D的盐溶液组成原电池,电极反应为:D2++2e-═D,B-2e-═B2+,该电池的电池反应式为
D2++B=D+B2+,所以氧化剂是D2+,氧化产物是B2+,所以D2+的氧化性>B2+的氧化性.
所以各离子的氧化性大小为D2+>B2+>A2+>E2+.
故选A.
点评 本题考查了离子的氧化性强弱比较,难度不大,根据同一反应中,氧化剂的氧化性>氧化产物的氧化性判断即可.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
4.下列说法正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 同一物质固、液、气三种状态的熵值相同 | |
| C. | △H<0、△S>0的反应可自发进行 | |
| D. | 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
1.某草药中有一种色素,它的结构简式为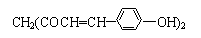 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
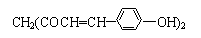 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )| A. | 3 mol、5 mol | B. | 6 mol、8 mol | C. | 10 mol、8 mol | D. | 6 mol、10 mol |
8.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 |
9.对于原子半径的理解,不正确的是( )
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
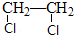 .
.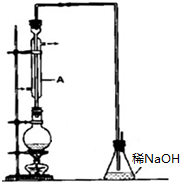 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下: