题目内容
14.设阿伏加德罗常数为NA,下列说法正确的是( )| A. | 0.1mol乙醇中含有C-H键的数目为0.6NA | |
| B. | 12g金刚石含有碳碳键数为4NA | |
| C. | 常温常压下,0.2mol的SiO2所含分子数为0.2NA | |
| D. | 31g白磷(P4)中含有(3/2)NA个P-P键 |
分析 A.根据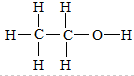 可知,乙醇分子中含有5个碳氢键;
可知,乙醇分子中含有5个碳氢键;
B.金刚石中,每个C形成了4个碳碳键,每个碳碳键为两个C共用,利用均摊法计算出含有共价键数目;
C.二氧化硅晶体为原子晶体,不存在二氧化硅分子;
D.白磷是正四面体型结构,分子中含有6个P-P共价键,31g白磷(分子式为P4)的物质的量0.25mol,含有1.5molP-P键.
解答 解:A.乙醇的结构式为: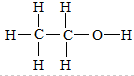 ,0.1乙醇分子中含有0.5mol碳氢键,含有C-H键的数目为0.5NA,故A错误;
,0.1乙醇分子中含有0.5mol碳氢键,含有C-H键的数目为0.5NA,故A错误;
B.12g金刚石物质的量为1mol,每1mol碳原子和4mol碳原子形成共价键,则1mol碳原子形成的共价键为:1mol×4×$\frac{1}{2}$=2mol,所以1mol金刚石含有碳碳键的个数为2NA,故B错误;
C.二氧化硅属于原子晶体,晶体中不存在SiO2分子,故C错误;
D.白磷是正四面体型结构,分子中含有6个P-P共价键,31g白磷(分子式为P4)的物质的量是:$\frac{31g}{31×4g/mol}$=0.25mol,含有P-P键的物质的量为:0.25mol×6=1.5mol,所以分子中含有P-P共价键1.5 NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,注意掌握阿伏伽德罗常数与物质的量之间的关系,明确结构式、白磷的空间结构,能够利用均摊法进行计算.

练习册系列答案
相关题目
4.如图是立方烷(cunane)的球棍模型,下列有关说法不正确的是( )
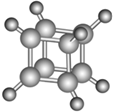

| A. | 其一氯代物只有一种 | |
| B. | 其二氯代物有三种同分异构体 | |
| C. | 常温下为气体 | |
| D. | 它与苯乙烯(C6H5-CH═CH2)互为同分异构体 |
5.下列关于如图物质的命名正确的是( )
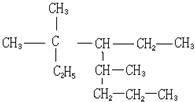

| A. | 2,4-二甲基-2,3-二乙基庚烷 | B. | 2,2,4-三甲基-3-乙基庚烷 | ||
| C. | 3,3,5-三甲基-4-乙基辛烷 | D. | 3,5,5-三甲基-5-乙基辛烷 |
2.下列关于糖类、蛋白质、油脂和纤维素的说法中,正确的是( )
| A. | 蛋白质溶液遇硫酸铜发生盐析 | |
| B. | 在一定条件下它们都能发生水解反应,淀粉和纤维素水解的最终产物都能发生银镜反应 | |
| C. | 油脂、糖类、蛋白质均是天然高分子化合物 | |
| D. | 油脂都是高级脂肪酸甘油酯,在碱性条件下发生皂化反应 |
19.下列排列顺序错误的是( )
| A. | 原子半径:O<S<Na | B. | 稳定性:HF>H2S>HCl | ||
| C. | 酸性:H2SiO3<H2CO3<HNO3 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
6.一定体积的N2、O2、CO2混合气体通过足量的Na2O2后,同温同压下体积变为原来的0.75倍,原混合气体中N2、O2、CO2物质的量之比可能为( )
| A. | 1:1:2 | B. | 4:3:5 | C. | 1:2:1 | D. | 6:7:14 |
3. 石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
 石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
 氨气
氨气
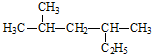 2,4-二甲基己烷
2,4-二甲基己烷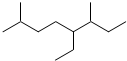 2,6-二甲基-5-乙基辛烷.
2,6-二甲基-5-乙基辛烷.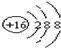 ,Br -的电子式:
,Br -的电子式: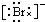 ,CO2的结构式:O=C=O
,CO2的结构式:O=C=O
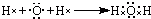 .
.