题目内容
19.下列排列顺序错误的是( )| A. | 原子半径:O<S<Na | B. | 稳定性:HF>H2S>HCl | ||
| C. | 酸性:H2SiO3<H2CO3<HNO3 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
分析 A.同周期元素原子半径依次减小,同主族从上到下依次增大;
B.元素的非金属性越强,其气氢化物的热稳定性越强;
C.元素非金属性越强,最高价氧化物水化物的酸性越强;
D.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.同周期元素原子半径依次减小,同主族从上到下依次增大,所以半径:O<S<Na,故A正确;
B.元素的非金属性越强,其气氢化物的热稳定性越强,非金属性:F>Cl>S,所以稳定性H2S<HCl<HF,故B错误;
C.元素非金属性越强,最高价氧化物水化物的酸性越强,非金属性:N>C>Si,所以酸性:H2SiO3<H2CO3<HNO3,故C正确;
D.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选:B.
点评 本题考查了元素金属性、非金属性的判断依据、元素性质的递变规律,题目难度小属于基础题,注意理解并记住相应的递变规律.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
10.NA代表阿佛加德罗常数,下列说法正确的是( )
| A. | 乙烯和环丙烷(C3H6)组成28g混合气体中含有3NA个氢原子 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA | |
| D. | 标准状况下1molH2S气体和1molSO2气体混合后,气体体积约为44.8L |
7.下列热化学方程式能表示可燃物的燃烧热的是( )
| A. | H2(g)+CL2(g)═2HCL(g)△h=-1846kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-8023kJ•mol-1 | |
| C. | 2C8H18(g)+25O2(g)═16CO2(g)+18H2O(1);△H=-5518KJ•mol-1 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1 |
14.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 0.1mol乙醇中含有C-H键的数目为0.6NA | |
| B. | 12g金刚石含有碳碳键数为4NA | |
| C. | 常温常压下,0.2mol的SiO2所含分子数为0.2NA | |
| D. | 31g白磷(P4)中含有(3/2)NA个P-P键 |
4.下列实验及操作能够达到预期实验目的是( )
| A. | 用广泛pH试纸测得某溶液的pH=6.7 | |
| B. | 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 | |
| C. | 可以选用氯水、四氯化碳来检验Cl-、Br-、I- | |
| D. | 在洁净的试管中加入1mL AgNO3溶液,再加入过量浓氨水,振荡制成银氨溶液 |
11.酚酞是一种重要的酸碱指示剂,它是一种弱酸,其结构如图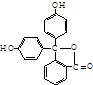 在一定条件下,跟1mol酚酞起反应的H2或溴水的最大量分别( )
在一定条件下,跟1mol酚酞起反应的H2或溴水的最大量分别( )
 在一定条件下,跟1mol酚酞起反应的H2或溴水的最大量分别( )
在一定条件下,跟1mol酚酞起反应的H2或溴水的最大量分别( )| A. | 10mol,4mol | B. | 10mol,3mol | C. | 9mol,4mol | D. | 9mol,3mol |
8.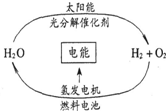 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )| A. | 燃料电池能够使化学反应产生的能量转化为电能 | |
| B. | 在此循环中发生了反应:2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+O2↑ | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
9.下列说法正确的是( )
| A. | 共价键都具有方向性 | |
| B. | 键能越大表示该分子越容易受热分解 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO4>HClO3>HClO2>HClO |