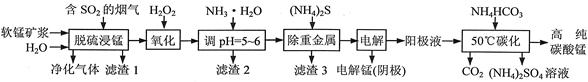
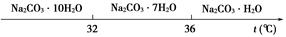题目内容
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
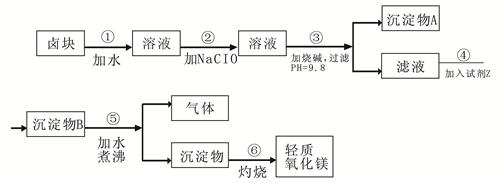
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
表2 化学试剂价格表
(1)在步骤②中加入漂液而不是双氧水其原因是 。
写出加入NaClO发生反应的离子方程式 。
(2)在步骤③中控制pH=9.8,其目的是 。
(3)沉淀物A的成分为 ,试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在 (填仪器名称)中灼烧。

已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
(1)在步骤②中加入漂液而不是双氧水其原因是 。
写出加入NaClO发生反应的离子方程式 。
(2)在步骤③中控制pH=9.8,其目的是 。
(3)沉淀物A的成分为 ,试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在 (填仪器名称)中灼烧。
(1)漂液比H2O2的价格低得多。(2分) 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O(3分)
(2)使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。(2分)
(3)Fe(OH)3 、 Mn(OH)2、 Mg(OH)2 (2分,写3个且全对得2分,只写其中2个且写对得1分,其他情况都得0分) 纯碱 (2分)
(4)MgCO3 +H 2O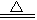 Mg(OH)2↓+ CO2↑ (3分,产物写成碱式碳酸镁也算正确)
Mg(OH)2↓+ CO2↑ (3分,产物写成碱式碳酸镁也算正确)
(5)坩埚 (2分)
(2)使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。(2分)
(3)Fe(OH)3 、 Mn(OH)2、 Mg(OH)2 (2分,写3个且全对得2分,只写其中2个且写对得1分,其他情况都得0分) 纯碱 (2分)
(4)MgCO3 +H 2O
 Mg(OH)2↓+ CO2↑ (3分,产物写成碱式碳酸镁也算正确)
Mg(OH)2↓+ CO2↑ (3分,产物写成碱式碳酸镁也算正确)(5)坩埚 (2分)
试题分析:(1)表2为一个试剂价格表,在漂白液和双氧水均可做氧化剂时,从经济角度应该选漂液更加实惠;因此加入漂白液次氯酸钠后发生的化学反应的离子方程式为
2Fe2+ + ClO-+ 2H+ = 2Fe3+ + Cl-+ H2O。
(2)从表1的离子沉淀PH值可以看出步骤③调节pH值目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。
(3)步骤③调节pH值使除Mg2+以外的各种杂质金属离子都沉淀了,但pH值已略微超过了Mg2+ 开始沉淀的pH值,所以得到的沉淀物A为Fe(OH)3 、 Mn(OH)2,也有 Mg(OH)2 ;沉淀物B在水中加热煮沸可以生成气体,同时又生成沉淀物Mg(OH)2 ,则沉淀物B一定不是Mg(OH)2 ,所以加入的Z物质在表2中只能选纯碱。
(4)加入的Z物质为纯碱,所以生成的沉淀物B是MgCO3,所以沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2 和CO2气体。化学方程式为MgCO3 +H 2O
 Mg(OH)2↓+ CO2↑ 。
Mg(OH)2↓+ CO2↑ 。(5)氢氧化镁灼烧制备氧化镁,应该在耐高温的容器坩埚中进行。

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目