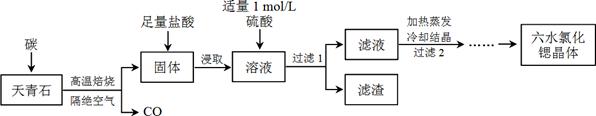
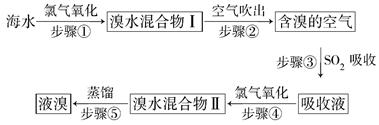
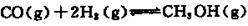题目内容
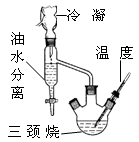
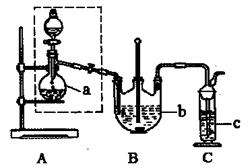
实验室可用如图所示的装置进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞,可供选用的试剂有NaHCO3溶液、NaOH溶液、NaHS溶液、浓硫酸、无水氯化钙、稀硫酸。试填空回答:

(1)广口瓶甲中应放的试剂为 ,广口瓶乙中应放的试剂为 ,分液漏斗丙中应放的试剂为 。
(2)第一步应先分离出 ,分离时应先关闭 。打开 ,发生反应的离子方程式为 。
(3)第二步分离出 时,先关闭 ,打开 ,发生反应的离子方程式为 。

(1)广口瓶甲中应放的试剂为 ,广口瓶乙中应放的试剂为 ,分液漏斗丙中应放的试剂为 。
(2)第一步应先分离出 ,分离时应先关闭 。打开 ,发生反应的离子方程式为 。
(3)第二步分离出 时,先关闭 ,打开 ,发生反应的离子方程式为 。
(1)NaOH溶液 浓硫酸 稀硫酸
(2)CO b a CO2+2OH-=CO32-+H2O
(3)CO2 a b CO32-+2H+=H2O+CO2↑
(2)CO b a CO2+2OH-=CO32-+H2O
(3)CO2 a b CO32-+2H+=H2O+CO2↑
CO与所提供试剂均不发生反应,而CO2可被碱液吸收形成盐,再用稀硫酸将CO2从盐中分离出来。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目